
 ��1�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ[��Ӧ��O2��g����������H2O��g����ȥ]��
��1�����dz��ô�����ѡ��Ӧ���еķ�����ͼ��ʾΪһ��������1mol CH3OH��O2������Ӧʱ������CO��CO2��HCHO�������仯ͼ[��Ӧ��O2��g����������H2O��g����ȥ]��| �¶ȣ��棩 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
| ѹǿ�ȣ�P��/Pǰ�� | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 1��91 |
| pH | 8.2 | 7.2 | 6.2 |
| ||
| ��t |
| 0.8 |
| 0.4��(0.4)2 |
| 0.6mol |
| 2 |
| ||
| 15min |
| 0.6mol |
| 2 |
| 0.3mol |
| 1mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ӻ������п��ܺ��й��ۼ� |
| B�����ۻ������п��ܻ������Ӽ� |
| C������Ԫ����ɵķ�����һ��ֻ�м��Լ� |
| D���ǽ���Ԫ����ɵĻ�����һ���ǹ��ۻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
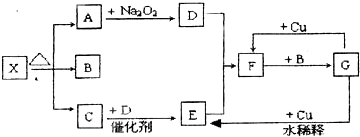
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������£�17.6g�����������ļ��Թ��ۼ�Ϊ4NA |
| B�������£�21.0g��ϩ�Ͷ�ϩ�Ļ�������к��е�̼ԭ����ĿΪ1.5NA |
| C��28g����ϩ��֬��ȫȼ��ʱ��ת�Ƶĵ�����ĿΪ3NA |
| D���ںϳ�28g����ϩ��֬�ĵ����У����е�˫����ĿΪ1.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�£�22.4L��ϩ��C-H����Ϊ4NA |
| B��1mol�ǻ��е�����Ϊ10NA |
| C���ڷ�ӦKIO3+6HI�TKI+3I2+3H2O�У�ÿ����3mol I2ת�Ƶĵ�����Ϊ6NA |
| D�������£�1L 0.1mol/L NH4NO3��Һ��NH4+����ĿС��6.02��1022 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com