


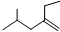
 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯分析 (1)甲基中含有3个碳氢键,碳原子最外层为7个电子;
(2)结构式中体现碳碳三键、单键;
(3)根据烷烃的通式计算出分子式,再根据支链越多,沸点越低写出该烷烃的结构简式;
(4)顺式氢原子位于同一侧;
(5)根据烷烃2,5-二甲基己烷的碳架,在该烷烃的碳架上添上碳碳三键即可;
(6)选含双键的最长碳链为主链;
(7)乙酸具有酸性,葡萄糖含有醛基,可与新制备氢氧化铜浊液在加热条件下反应,则可用氢氧化铜检验.乙酸、乙醇、乙酸乙酯、葡萄糖分别与碱性Cu(OH) 2悬浊液混合,现象分别为蓝色溶液、不反应不分层、不反应分层、砖红色沉淀.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为 ,故答案为:
,故答案为: ;
;
(2)乙炔的结构简式为H-C≡C-H,故答案为:H-C≡C-H;
(3)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:C(CH3)4;支链越多,沸点越低,其中C(CH3)4的沸点最低,
故答案为:C(CH3)4;
(4)顺式聚1,3-丁二烯的结构简式 ,故答案为:
,故答案为: ;
;
(5)2,5-二甲基己烷的碳架为:C-C(C)-C-C-C(C)-C,在该碳架上添加碳碳三键,可以得到炔烃,该炔烃的结构简式为: ,名称为2,5-二甲基-3-己炔,故答案为:2,5-二甲基-3-己炔;
,名称为2,5-二甲基-3-己炔,故答案为:2,5-二甲基-3-己炔;
(6)选含双键的最长碳链为主链, 的系统命名:4-甲基-2-乙基-1-戊烯,故答案为:4-甲基-2-乙基-1-戊烯;
的系统命名:4-甲基-2-乙基-1-戊烯,故答案为:4-甲基-2-乙基-1-戊烯;
(7)加入新制氢氧化铜,乙醇无现象,乙酸溶解氢氧化铜,加热时,葡萄糖溶液中生成砖红色沉淀,所以乙醇、乙酸、乙酸乙酯、葡萄糖分别与碱性Cu(OH) 2悬浊液混合,现象分别为不反应不分层、蓝色溶液、不反应分层、砖红色沉淀,现象不同,可鉴别,故答案为:新制Cu(OH)2悬浊液.
点评 本题考查了电子式的书写、有机物结构式的书写、常见有机物分子式确定以及命名等,题目难度中等,注意掌握电子式的概念及书写方法,明确有机物结构与性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
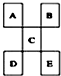
| A. | D一定是金属元素,其金属性比C强 | |
| B. | C的最高价氧化物水化物显强酸性 | |
| C. | B的氢化物是以分子形式存在,且某些分子间存在氢键 | |
| D. | E的原子序数一定是A的5倍,且原子半径比A大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
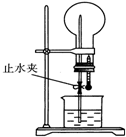 如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )
如图装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,然后打开止水夹.下列与实验事实不相符的是( )| A. | Cl2(饱和食盐水) 无色喷泉 | B. | NH3(H2O含石蕊) 蓝色喷泉 | ||
| C. | HCl(H2O含石蕊) 红色喷泉 | D. | SO2(NaOH溶液) 无色喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
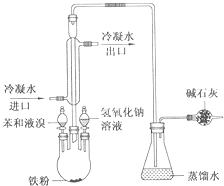 图是实验室制取溴苯的装置图
图是实验室制取溴苯的装置图 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期 IVA族 | B. | 第三周期 IV A族 | C. | 第三周期 VI A族 | D. | 第二周期VI A族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
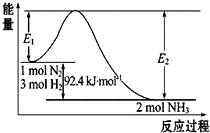 合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:
合成氨工业的核心反应是:N2(g)+3H2(g)?2NH3(g)△H=“Q“kJ•mol-1,能量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和乙烯 | B. | 甲烷和丙烯 | C. | 乙烷和乙烯 | D. | 甲烷和丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 表中最稳定的共价键是H-F | B. | H2(g)=2H(g)需吸收436kJ的能量 | ||
| C. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | D. | 反应H2(g)+F2(g)=2HF(g)放出25kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb为正极被氧化 | B. | SO42-只向PbO2处移动 | ||
| C. | Pb电极质量减少 | D. | 电解质溶液的pH不断增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com