
| A. | 22.4L | B. | 11.2L | C. | 44.8L | D. | 89.6L |
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
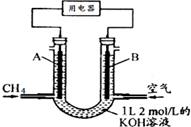 将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.则下列说法正确的是( )| A. | OH-由A端移向B端 | |
| B. | 0<V≤22.4L时,电池总反应的化学方程式为:CH4+2O2+KOH═KHCO3+2H2O | |
| C. | 22.4L<V≤44.8L时,负极电极反应为:CH4-8e-+9CO32-+3H2O=10HCO3- | |
| D. | V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L的NaHCO3溶液中粒子浓度的关系:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | 0.2 mol/L的HCl和0.1 mol/L的NH3•H2O等体积混合后溶液中的离子浓度关系: c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| C. | pH相同的CH3COONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(NaOH) | |
| D. | 0.1 mol/L的NaHS溶液中粒子浓度关系:c(S2-)+c(OH-)=(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据上述过程,每生成1molKMnO4,共转移6mol电子 | |
| B. | 第二步电解时,阳极电极反应式为2MnO42--2e-=2MnO4- | |
| C. | 第二步电解的离子方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+OH- | |
| D. | 第二步电解时阴极周围pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=8.3 的NaHCO3溶液:[Na+]>[HCO3-]>[CO32-]>[H2CO3] | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 阴极增重1.72g | B. | 所得溶液 pH<1 | C. | 阴极增重0.64g | D. | 所得溶液pH>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
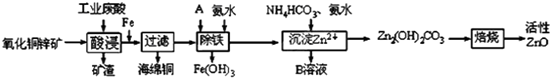
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeBr2洛液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| B. | Cl2通入水中:Cl2+H20═2H++Cl-+ClO- | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H20═2Cu+O2+4H+ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使S042-恰好完全沉淀:2Ba2++3OH-+Al3++2S042-═2BaS04+Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com