
| A. | SO2为还原产物,NH3为氧化产物 | |
| B. | 所得三种气体形成的混合气体平均摩尔质量可能为16 g/mol | |
| C. | 被氧化的氮元素与未被氧化的氮元素质量比为1:2 | |
| D. | 相同条件下,产生的三种气体原子数之比为3:1:4 |
分析 3(NH4)2SO4$\frac{\underline{\;强热\;}}{\;}$3SO2↑+N2↑+4NH3↑+6H2O反应中,N元素的化合价由-3价升高为0,S元素的化合价由+6价降低为+4,结合化合价的变化来解答.
解答 解:A.反应中S元素化合价由+6价降低到+4价,被还原,则SO2为还原产物,铵根离子转化为氨气,N元素没有变价,所以NH3不是氧化产物,故A错误;
B.三种气体的摩尔质量都大于16g/mol,所以形成的混合气体平均摩尔质量大于16 g/mol,故B错误;
C.反应中6molN参加反应,被氧化的N为2mol,未被氧化的N为4mol,所以被氧化的氮元素与未被氧化的氮元素质量比为1:2,故C正确;
D.相同条件下,产生的三种气体分子数之比为3:1:4,故D错误.
故选C.
点评 本题考查氧化还原反应、阿伏伽德罗定律,把握反应中元素的化合价变化为解答的关键,由元素的化合价变化及电子守恒的角度解答该题,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 1 mol•L-1 NaNO3 溶液 | B. | 10 mL 1 mol•L-1Al(NO3)3 溶液 | ||
| C. | 15 mL 2 mol•L-1 AgNO3 溶液 | D. | 10 mL 1.5 mol•L-1Cu(NO3)2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
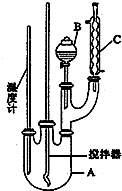 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: ,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:
,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 若平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ | |
| B. | 上述反应的逆反应是放热反应 | |
| C. | 该反应的化学方程式是:CO2(g)+H2(g)?CO(g)+H2O(g) | |
| D. | 若在一定体积的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com