
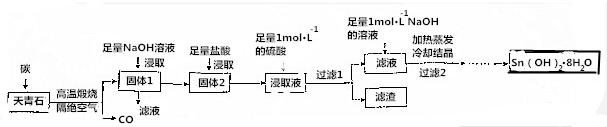
分析 以天青石(主要成分为SrSO4含有BaCO3、SiO2)为原料制备八水合氢氧化锶[Sr(OH)2•8H2O],由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,加NaOH溶解SiO2,过滤后剩余固体中主要含有SrS,加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,再加入足量NaOH溶液,最后蒸发、冷却结晶得到Sr(OH)2•8H2O;
(1)研磨粉碎可以增加反应物的接触面积,提高反应速率,提高原料的转化率;
(2)焙烧过程中发生的主反应为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑,根据元素的化合价的变化判断还原剂,氧化产物为CO,每个碳由0价升高为+2价,据此计算电子转移数目;
(3)用HCl溶解SrS后的溶液中含有杂质钡离子,加入硫酸的后生成硫酸钡沉淀从而除去溶液中Ba2+杂质;
(4)根据钡离子浓度、硫酸钡的溶度积计算出钡离子完全除去时硫酸根离子的浓度,然后根据硫酸锶的溶度积计算出需要锶离子的最小浓度;
(5)过滤1后的滤液中含有氯化锶,加入过量氢氧化钠溶液后,生成了氢氧化锶,再蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得Sr(OH)2•8H2O;
(6)称取2.80g该产品(含少量无机盐杂质)于坩埚中,加热至恒重,称得剩余固体质量为1.18g,质量的减轻为2.80g-1.18g=1.62g,根据Sr(OH)2•8H2O分解反应计算样品中Sr(OH)2•8H2O的质量并计算纯度.
解答 解:以天青石(主要成分为SrSO4含有BaCO3、SiO2)为原料制备八水合氢氧化锶[Sr(OH)2•8H2O],由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,加NaOH溶解SiO2,过滤后剩余固体中主要含有SrS,加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,再加入足量NaOH溶液,最后蒸发、冷却结晶得到Sr(OH)2•8H2O;
(1)天青石焙烧前为了增加反应物的接触面积,提高化学反应速率,从而提高原料的转化率可以先研磨粉碎,故答案为:研磨粉碎;
(2)焙烧过程中发生的主反应为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑,焙烧过程中由0价升高为+2价,所以碳为还原剂,氧化产物为CO,当有5mol碳被氧化共转移10mol电子,故答案为:碳;10NA;
(3)用盐酸溶解后的浸取液里含有Ba2+,滴加稀硫酸,有BaSO4沉淀生成,过滤后得到滤渣为BaSO4,故答案为:BaSO4;
(4)由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=$\frac{1.1×10{\;}^{-10}}{1×10{\;}^{-5}}$mol/L=1.1×10-5mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=$\frac{3.3×10{\;}^{-7}}{1.1×10{\;}^{-5}}$mol/L=3.0×10-2=0.03mol/L,
故答案为:0.03;
(5)将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得Sr(OH)2•8H2O,
故答案为:洗涤、干燥;
(6)设固体中含有Sr(OH)2•8H2O质量为mg,
Sr(OH)2•8H2O$\frac{\underline{\;\;△\;\;}}{\;}$SrO+9H2O
266 162
mg 1.62g
m=2.66g,产品的纯度为$\frac{2.66g}{2.80g}$×100%=95%,
故答案为:95%.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中发生的化学反应及物质分离方法为解答的关键,涉及反应速率、氧化还原反应、滴定原理等,注意信息与所学知识的综合应用,综合性较强,题目难度较大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将盐卤或石膏加入豆浆,制成美味可口的豆腐 | |
| B. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀,即可制得Fe(OH)3胶体 | |
| C. | 放电影时,放映室射到屏幕上的光柱 | |
| D. | 在盛有红褐色Fe(OH)3胶体的U形管两端加上直流电压后,阴极附近颜色逐渐加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.
前四周期原子序数依次增大的六种元素,A、B、C、D、E、H中,A元素在宇宙中含量最丰富,B元素基态原子的核外有3种能量不同的原子轨道,且每种轨道中的电子数目相同.D元素是地壳中含量最多的元素,E为d区元素,其外围电子排布中有4对成对电子,H元素基态原子最外层只有一个电子,其它层均已充满电子.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HBr、HCl、BaSO4 | B. | NH4Cl、CH3COONa、Na2S | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、NaF、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 镁在空气中或纯净氧气中燃烧的产物都只有MgO | |
| B. | 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 | |
| C. | 将四氧化三铁溶解于过量的硝酸中,所得溶液中无Fe2+ | |
| D. | 氯化铝和过量的氨水反应一定得到Al(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
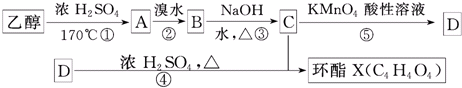
 +2H2O
+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com