
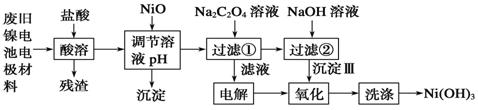
分析 将废旧镍电池电极材料溶于稀盐酸,发生反应Ni(OH)2+2HCl=NiCl2+2H2O、Fe2O3+6HCl=2FeCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑,过滤得到的残渣是C,向滤液中加入NiO,条件溶液的pH,根据流程图知,生成的沉淀应该是Fe(OH)3、Al(OH)3,然后向滤液中加入Na2C2O4溶液,发生反应NiCl2+Na2C2O4=NiC2O4↓+2NaCl,过滤,将滤液电解,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,过滤得到的NiC2O4和NaOH反应生成Ni(OH)2,用氯气将Ni(OH)2氧化生成Ni(OH)3,最后洗涤沉淀得到较纯净的Ni(OH)3,根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,充电时消耗氢氧根,阴极附近溶液的pH升高,据此分析解答.
解答 解:将废旧镍电池电极材料溶于稀盐酸,发生反应Ni(OH)2+2HCl=NiCl2+2H2O、Fe2O3+6HCl=2FeCl3+3H2O、2Al+6HCl=2AlCl3+3H2↑,过滤得到的残渣是C,向滤液中加入NiO,条件溶液的pH,根据流程图知,生成的沉淀应该是Fe(OH)3、Al(OH)3,然后向滤液中加入Na2C2O4溶液,发生反应NiCl2+Na2C2O4=NiC2O4↓+2NaCl,过滤,将滤液电解,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,过滤得到的NiC2O4和NaOH反应生成Ni(OH)2,用氯气将Ni(OH)2氧化生成Ni(OH)3,根据铁镍蓄电池放电时总反应:Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,可判断电解液为碱性,充电时消耗氢氧根,阴极附近溶液的pH升高.
(1)通过以上分析知,酸溶时能与盐酸反应的物质是Al、Ni(OH)2、Fe2O3,
故答案为:碳粉;
(2)用NiO调节溶液的pH,析出沉淀的成分为Fe(OH)3、Al(OH)3,故答案为:Fe(OH)3、Al(OH)3;
(3)加入Na2C2O4溶液后反应的化学方程式为:Na2C2O4+NiCl2+2H2O=2NaCl+NiC2O4•2H2O↓,
故答案为:Na2C2O4+NiCl2+2H2O=2NaCl+NiC2O4•2H2O↓;
(4)加入NaOH溶液,NiC2O4沉淀转化为Ni(OH)2,NiC2O4+2OH-?Ni(OH)2+C2O42-,根据Ksp(NiC2O4):4.0×10-10
c(Ni2+)=c(C2O42-)=$\sqrt{{K}_{sp}}$=$\sqrt{4×1{0}^{-10}}$=2×10-5mol/L;
根据Ksp(Ni(OH)2):5.0×10-16,c2(OH-)=$\frac{{K}_{sp}[Ni(OH)_{2}]}{c(N{i}^{2+})}$=$\frac{5.0×1{0}^{-16}}{2.0×1{0}^{-5}}$=2.5×10-11mol2/L2;
则该反应的平衡常数K=$\frac{c({C}_{2}{{O}_{4}}^{2-})}{{c}^{2}(O{H}^{-})}$=$\frac{2×1{0}^{-5}}{2.5×1{0}^{-11}}$=8×105L/mol;
故答案为:NiC2O4+2OH-?Ni(OH)2+C2O42-;8×105L/mol;
(5)电解过程中阴极反应是水得电子产生氢气,电极反应式为:2H2O+2e-═H2↑+2OH-;电解NaCl溶液可以得到氧化性物质氯气,所以沉淀Ⅲ可被电解所得产物Cl2氧化生成Ni(OH)3,该氧化反应的离子方程式为:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-,
故答案为:2H2O+2e-═H2↑+2OH-;2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
点评 本题考查混合物的分离和提纯,题目难度中等,涉及离子反应方程式的书写、平衡常数的计算、沉淀的洗涤等知识点,综合性较强,为高考高频点,明确每一步中发生的反应及物质的性质、物质分离方法即可解答,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.10mol H2O含有含有原子数为0.3NA | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 0.10mol•L-1Na2CO3溶液中含有Na+0.2NA | |
| D. | 14g CO和N2的混合气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备的晶体硅可用于制作计算机芯片 | |
| B. | 该法制备高纯硅,可以综合利用氯气和氢气,使原料循环利用,生产成本低,效率高 | |
| C. | 该过程是把硅转化为SiHCl3与杂质分离,而后用氢气还原得到高纯硅 | |
| D. | 整个制备过程中若混有氧气可以不除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol熔融的KHSO4中含有2 NA个阳离子 | |
| B. | 1 L 0.1 mol/LCH3COONa溶液中,阴离子总数小于0.1 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA | |
| D. | 与常温常压下17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
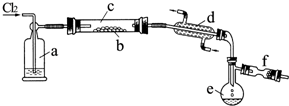 氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与明矾处理水的原理完全相同 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烷体积比为1:4 | B. | 乙烯与丁烷体积比为4:1 | ||
| C. | 丙炔与乙炔物质的量比为4:1 | D. | 乙烯与丁烯物质的量比为1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com