
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 预测可能观察到的实现现象 | 对应的化学方程式或离子方程式 |
| 1.向AlCl3溶液中逐滴加入NaOH至过量 | ||
| 2.往FeSO4溶液逐滴滴入一定量的NaOH溶液,放置一段时间. |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
||||||||
| ① | ||||||||
| ② | ||||||||
| ③ | ④ | ⑤ | ⑥ | |||||
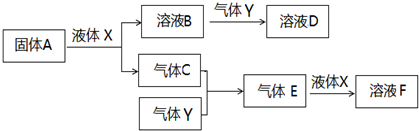
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
| B、向100mL 0.1mol/L FeBr2溶液中通入0.01mol的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C、AlCl3溶液与过量氨水混合:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、向Mg(HCO3)2中加足量的Ca(OH)2溶液:Ca2++2OH-+2HCO3-+2Mg2+=CaCO3↓+MgCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 | B、4 | C、6 | D、8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com