
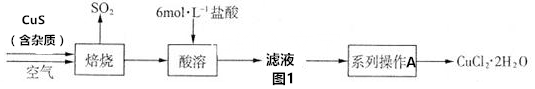

分析 CuS在焙烧过程中发生氧化还原反应,依次有Cu2S、CuO•CuSO4、CuSO4、CuO生成,硫化铜中的硫最终转化成二氧化硫,同时生成CuO,加入盐酸,过滤得到氯化铜溶液,经蒸发浓缩、冷却结晶得到产品.
(1)第Ⅰ阶段是硫化铜与氧气反应生成硫化亚铜和二氧化硫,据此写出反应的化学方程式;
(2)酸溶时是氧化铜与盐酸反应,据此写出离子方程式;
(3)操作A实验的目的是从氯化铜溶液中得到CuCl2•2H2O,根据蒸发浓缩、冷却结晶和过滤选择;
(4)硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2,验证所得气体中有SO2和O2,需排尽A装置中的空气,用装置B制取干燥的二氧化碳,先通入二氧化碳排尽A中的空气,再对A进行加热,用浓硫酸吸收水和三氧化硫,进入氯化钡溶液的气体只有二氧化硫和氧气,当氯化钡中产生白色沉淀,说明所得气体有有SO2和O2,再用E进行尾气吸收.
①由分析可知实验装置的正确连接顺序;实验前必须检查装置的气密性;
②装置B的作用是制得二氧化碳气体,排除装置内空气;二氧化硫有毒,且是酸性氧化物,可用氢氧化钠溶液吸收;
③只有二氧化硫通入氯化钡溶液时,不发生反应,无明显现象,若同时有氧气通入,会发生氧化还原反应生成硫酸钡沉淀;
④硫化铜中有不反应的杂质,反应前是CuS和杂质12g,最终是CuO和杂质10.4g,质量差为12g-10.4g=1.6g,等于硫元素与氧元素的质量差,则CuS物质的量应为0.1mol,计算出其质量,再算出质量分数.
解答 解:CuS在焙烧过程中发生氧化还原反应,依次有Cu2S、CuO•CuSO4、CuSO4、CuO生成,硫化铜中的硫最终转化成二氧化硫,同时生成CuO,加入盐酸,过滤得到氯化铜溶液,经蒸发浓缩、冷却结晶得到产品.
(1)根据CuS矿样在焙烧过程中转化顺序可知,第Ⅰ阶段反应为硫化铜转化成硫化亚铜,反应的化学方程式为:2CuS+O2$\frac{\underline{\;加热\;}}{\;}$Cu2S+SO2,
故答案为:2CuS+O2$\frac{\underline{\;加热\;}}{\;}$Cu2S+SO2;
(2)酸溶时是氧化铜与盐酸反应,离子反应方程式为:,
故答案为:CuO+2H+=Cu2++H2O;
(3)操作A实验的目的是从氯化铜溶液中得到CuCl2•2H2O,需要的操作方法按照操作顺序依次是:蒸发浓缩、冷却结晶和过滤,所以需要的装置为b,故答案为:b;
(4)硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2,验证所得气体中有SO2和O2,需排尽A装置中的空气,用装置B制取干燥的二氧化碳,先通入二氧化碳排尽A中的空气,再对A进行加热,用浓硫酸吸收水和三氧化硫,进入氯化钡溶液的气体只有二氧化硫和氧气,当氯化钡中产生白色沉淀,说明所得气体有有SO2和O2,再用E进行尾气吸收.
①由分析可知实验装置的正确连接顺序是B→D→A→D→C→E,反应装置有多个仪器组合而成,实验前必须检查装置的气密性,
故答案为:B;A;D;C;E;检查装置气密性;
②装置B的作用是制得二氧化碳气体,排除装置内空气;二氧化硫有毒,污染空气,可用氢氧化钠溶液吸收,则E中的试剂是氢氧化钠溶液,
故答案为:制得二氧化碳气体,排除装置内空气;氢氧化钠溶液;
③只有二氧化硫通入氯化钡溶液时,不发生反应,无明显现象,若同时有氧气通入,会生成硫酸钡沉淀,所以当C中有白色沉淀产生时,说明产生的气体中有二氧化硫和氧气,
故答案为:C中产生白色沉淀;
④硫化铜中有不反应的杂质,反应前是CuS和杂质12g,最终是CuO和杂质10.4g,质量差为12g-10.4g=1.6g,等于硫元素与氧元素的质量差,则CuS物质的量应为0.1mol,质量为0.1mol×96g/mol=9.6g,质量分数为$\frac{9.6g}{12g}$×100%=80%,
故答案为:80%.
点评 本题考查CuCl2•2H2O晶体的制备方法、性质实验方案的设计等,题目难度较大,最后的质量分数计算是难点,容易忽略杂质不参加反应,错误认为10.4g就是氧化铜的质量,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 酸化的淀粉溶液 | B. | 硫酸钠溶液 | C. | H2O2溶液 | D. | 氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某些金属、非金属元素化合时也能形成共价键 | |
| B. | 只有阴、阳离子间才能形成离子键 | |
| C. | 升温能加快钠与氧气反应生成氧化钠反应的速率 | |
| D. | FeCl2不能通过两种单质化合反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价等于它所处的主族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36 L煤油含有9.03×1022个煤油分子 | |
| B. | 常温常压下,2 g氢气含有的原子数为1.204×1024个 | |
| C. | 同温同压下,相同体积的任何气体所含的原子数相等 | |
| D. | 22.4 L气体所含分子数一定大于11.2 L气体所含分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12mol/L | B. | 1×10-12mol/L | C. | 0.01mol/L | D. | 大于0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3与CH3CH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com