
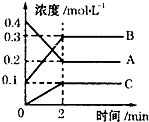
 一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )| A、反应开始到2min,用A表示的反应速率为0.1 mol?Lˉ1?minˉ1 |
| B、反应开始到2min,B的物质的量浓度增加了0.2mol/L |
| C、反应进行到2min时,该反应停止了 |
| D、反应的化学方程式为:2A(g)?2B(g)+C(g) |
| 0.2mol/L |
| 2min |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、开发高效氢能、太阳能等新型电动汽车,以解决城市机动车尾气排放问题 |
| B、高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有危害 |
| C、PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重 |
| D、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O,故对环境不造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
| A、增大压强,反应速率减小 |
| B、最终可生成0.2 mol NH3 |
| C、升髙温度,反应速率增大 |
| D、当v正(N2):v正(H2)=1:3时,一定达化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1<△H2 |
| B、△H1=△H2 |
| C、△H1>△H2 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
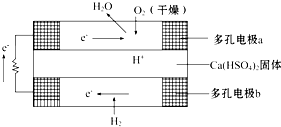 如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2═2H2O,下列有关说法不正确的是( )| A、H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B、a极上的电极反应式为:O2+2H2O+4e-═4OH- |
| C、每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D、H+由b极通过固体酸电解质传递到a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素A所形成的氧化物只有一种 |
| B、元素B的最高价氧化物对应的水化物为强酸 |
| C、元素C、D、E的最高价氧化物对应的水化物两两之间可发生反应 |
| D、氢化物的稳定性:A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com