
 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
分析 (1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式;3d能级上的未成对的电子数为2;
(2)非金属性越强,电负性越强;乙酸分子中含有甲基碳原子和羧基碳原子,根据价层电子对互斥理论判断碳原子的轨道杂化类型;乙酸分子中单键为σ键,双键中含有1个σ键和1个π键,据此进行解答;
(3)锗的卤化物都是分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高;
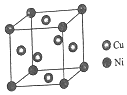
(4)①该晶胞中Ni原子个数=8×$\frac{1}{8}$=1、Cu原子个数=6×$\frac{1}{2}$=3;
②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=$\root{3}{\frac{\frac{M}{{N}_{A}}}{ρ}}$.
解答 解:(1)Ni是28号元素,其原子核外有28个电子,根据构造原理书写镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2,
故答案为:1s22s22p63s23p63d84s2或[Ar]3d84s2;
(2)CH3COOH分子中含有C、O、H元素,非金属性:O>C>H,则电负性:O>C>H;
CH3COOH分子内含有甲基碳原子和羧基碳原子,甲基碳原子中形成4个σ键,为sp3杂化,羧基碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化;
CH3COOH分子中含有3个C-H键、1个C-C键、1个O-H键、1个C-O单键及1个碳氧双键,单键为σ键,双键中含有1个σ键和1个π键,所以CH3COOH分子中含有7个σ键、1个π键,σ键与π键数目之比为7:1,
故答案为:O>C>H; sp3和sp2;7:1;
(3)锗的卤化物都是分子晶体,分子间通过分子间作用力结合,对于组成与结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高,由于相对分子质量:GeCl4<GeBr4<GeI4,故沸点:GeCl4<GeBr4<GeI4,
故答案为:GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强;
(4)①该晶胞中Ni原子个数=8×$\frac{1}{8}$=1、Cu原子个数=6×$\frac{1}{2}$=3,则Cu、Ni原子个数之比为3:1,故答案为:3:1;
②该晶胞的化学式为Cu3Ni,若合金的密度为dg/cm3,晶胞参数=$\root{3}{\frac{\frac{M}{{N}_{A}}}{ρ}}$=$\root{3}{\frac{\frac{251}{{N}_{A}}}{d}}$cm=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm,故答案为:$\root{3}{\frac{251}{d{N}_{A}}}$×107.
点评 本题考查较为综合,涉及晶胞计算、价层电子对互斥理论、电负性、物质熔沸点比较等知识,题目难度中等,侧重考查学生对物质结构、基本理论的理解和运用,试题综合性较强,充分考查了学生的分析、理解能力及综合应用能力.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲醛的电子式: | |
| B. | Cl-的结构示意图 | |
| C. | S2-核外电子排布式ls22s22p63s23p6 | |
| D. | 碳-12原子构成${\;}_{6}^{12}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | a极为负极,电极上发生氧化反应 | |
| B. | 电池总反应可表示为:2H2+O2═2H2O | |
| C. | 外电路中电子由b电极通过导线流向a电极 | |
| D. | 该装置工作时把电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯酸钾制取氧气时可加入少量的高锰酸钾以加快反应速率 | |
| B. | 为加快制取氢气的速率用锌粉代替锌粒 | |
| C. | 为降低HNO3与Cu反应制备NO2的速率可以采用稀硝酸代替浓硝酸 | |
| D. | 为了延长食品的保质期在食品包装袋中加入硅胶、硫酸亚铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水 | B. | NaHCO3溶液 | C. | 乙醇 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C9H11O2N | B. | 能合成高分子化合物 | ||
| C. | 能发生加成反应 | D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Z>Y>X | C. | Y>Z>X | D. | Y>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )| A. | 原溶液中一定含有的阳离子是H+、NH4+、Fe3+、Al3+ | |
| B. | 原溶液中一定含有SO42- | |
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | |
| D. | 反应最后形成的溶液中溶质为Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com