
A、B、C、D、E为原子序数依次增大的短周期元素,其中只有一种是金属元素。A、D元素原子最外层电子数相同,且A和D可形成离子化合物,C2 - 和D+ 具有相同的电子数,E元素的最高正化合价与最低负化合价之和为2。由这些元素组成的物质,其组成和结构信息如下表:

请用化学用语回答下列问题:
(1) D+ 的结构示意图为 ;
(2) C、D、E的氢化物按熔点由高到低排列的顺序为 ;
(3) 乙属于 分子(填“极性”或“非极性”),丁的电子式为 ,
(4) 将少量甲投入到AlCl3溶液中反应的离子方程式为 ;
(5) 丙属于 晶体,丙中每个原子均形成4个共价键,其中有一个配位键,提供空轨道的是 ;
氮化硼晶体的熔点要比丙晶体高,其原因是 。
科目:高中化学 来源: 题型:
某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 。1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为
98%的浓硫酸 mL。
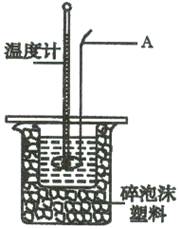
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1)
;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c= 4.18 J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。
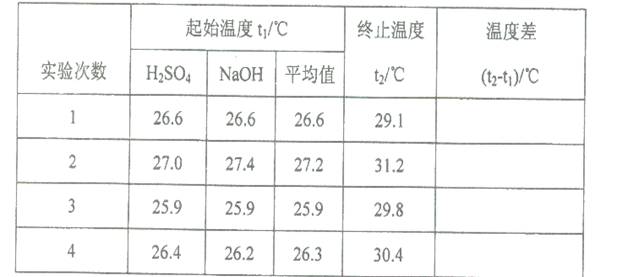
③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上通常用下列方法治理含氮化合物的污染。
(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染。已知:
N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=—221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=—393. 5 kJ/mol
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式 。
(2)用NH3还原NOx生成N2和H2O。现有NO、NO2的混合气3 L,可用同温同压下3.5 L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为 。
(3)电化学降解治理水中硝酸盐污染。在酸性条件下,电化学降解NO 的原理如图1,A为电源的 极,阴极反应式为 。
的原理如图1,A为电源的 极,阴极反应式为 。
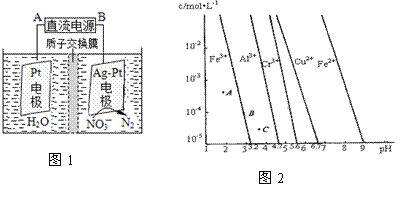

(4)通过控制溶液的pH对工业废水中的金属离子进行分离。图2是某些金属氢氧化物在不同浓度和pH时的沉淀——溶解图像,图中直线上的点表示平衡状态。当溶液中的离子浓度小于1×10-5 mol·L-1时,认为该离子沉淀完全。
①相同条件下,Fe (OH)3、Al(OH)3、Cr(OH)3三种物质的溶度积常数最大的是 ,
图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是 。
②由图可得Fe(OH)2的溶度积的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列判断正确的是( )
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
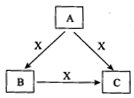

①A中所含有的化学键是_____________, X属于的晶体类型是_________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中发生的离子反应方程式为______。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为______ g
查看答案和解析>>
科目:高中化学 来源: 题型:
往甲、乙、丙、丁四个烧杯内分别放入0.1 mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100 mL 的水,搅拌,使固体完全溶解。则甲、乙、丙、丁溶液中溶质的质量分数大小的顺序是 ( )
A.甲<乙<丙<丁 B.甲=丁<乙=丙 C.丁<甲<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com