
若每升温10℃可使反应速率增至原反应速率的3倍,当从50℃升温至90℃时,则反应速率增加的倍数是( )
A.8倍 B.12倍 C.80倍 D.81倍
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
 在容积不变的密闭容器中,一定条件下进行如下反应:
在容积不变的密闭容器中,一定条件下进行如下反应:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.8倍 B.12倍 C.80倍 D.81倍
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.8倍 B.12倍 C.80倍 D.81倍
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)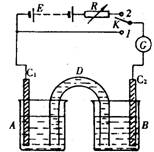 装置如右图:D是允许通过离子的盐桥,E是48V稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
装置如右图:D是允许通过离子的盐桥,E是48V稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯。
1.已知AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
AsO33-+I2+H2O是可逆反应。若A中盛KI-I2溶液,B中盛Na3AsO4和Na3AO3溶液,则当K接1,并向B中滴加浓盐酸时发现G中的指针发生偏转;改向B中滴加40%的NaOH溶液时,G中的指针则向反方向偏转。
(1)两次操作过程中指针偏转的原因是
(2)指针偏转方向相反的原因是
(3)加盐酸时C1上发生的反应是
(4)加NaOH溶液时C1上发生的反应是
2.当 A中盛适量的1mol/L Na2SO4溶液,B中盛40mL适量浓度的KI-KHCO3溶液,且K接2时,可用该装置来测定砷的含量。其操作如下:称取5.00g含砷样品,溶解后加入还原剂,使砷全部转化为HAsO32-,除去过量的还原剂后再转移到250mL容量瓶中配成250mL溶液,用移液管从中取出10mL加入B中,边搅拌边电解,电解生成的 I2可将HAsO32-快速、定量地氧化为HAsO42-,以2mA的电流电解241s便可使反应进行完全。
(1)反应到达终点时宜用 来指示;
(2)假设电能没有损失,试求样品中As2O5的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com