
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解Al2O3的离子方程式是___________________________________
_________________________。
(2)将MnO4—氧化Fe2+的离子方程式补充完整:42—

(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1 mol·L-1。
根据表中数据解释步骤Ⅱ的目的____________________________________。
(4)已知:一定条件下,MnO4— 可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是
_________________________________________________________________。
②Ⅳ中加入MnSO4的目的是______________________________________。
(1)Al2O3+6H+=2Al3++3H2O
(2)5 8H+ 5 4H2O
(3)pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)①生成黄绿色气体 ②除去过量的MnO4—
【解析】(1)H2SO4溶解Al2O3的离子方程式为:Al2O3+6H+=2Al3++3H2O,在操作Ⅰ中,FeO·xFe2O3也同时被溶解,滤液中含有Al3+、Fe2+、Fe3+等。
(2)步骤Ⅰ所得溶液中会有过量H2SO4,故反应在酸性条件下进行,由氧化还原反应中得失电子守恒可知MnO4—和Fe2+的化学计量数之比为1∶5,然后观察配平。得MnO4—+5Fe2++8H+=Mn2++5Fe3++4H2O。
(3)步骤Ⅱ中,加入过量KMnO4溶液目的是把Fe2+氧化成易除去的Fe3+。调节pH约为3,由表中数据分析,可知该条件使Fe3+完全沉淀而Al3+不被沉淀,从而达到分离Fe3+和Al3+的目的。
(4)①联想Cl2的实验室制法,很容易分析实验设计的意图,即通过是否产生Cl2来判断沉淀中有无MnO2。②操作Ⅳ中加入MnSO4,紫红色消失,说明过量的MnO4—因加入MnSO4而被转化成沉淀,然后过滤,以除去MnO4—,保证产品的纯度。


科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第5讲化学反应与能量练习卷(解析版) 题型:选择题
下列关于化学反应的描述中正确的是( )。
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,也放出57.3 kJ的热量
C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-283.0 kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则b>a
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第1讲物质组成性质分类练习卷(解析版) 题型:选择题
下列有关物质分类一定正确的是( )。
①强电解质:氯化氢、氢氧化钡、摩尔盐 ②弱电解质:草酸、纯碱、醋酸铵 ③非电解质:液氨、二氧化硫、苯 ④同系物:CH2O2、C2H4O2、C3H6O2
A.①②③ B.①③ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第12讲化学实验基础练习卷(解析版) 题型:选择题
安全是顺利进行实验的保障,下列实验处理或方法正确的是( )。
A.尾气(主要含氯气)用澄清石灰水吸收较好
B.把氢气和氯气混合光照制氯化氢
C.导管口点燃一氧化碳时也要验纯
D.重金属盐有毒,如果不慎食入氯化钡,喝硫酸铜溶液即可
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第11讲有机化学基础练习卷(解析版) 题型:填空题
某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下。

已知:
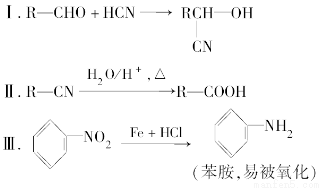
请回答下列问题:
(1)C的分子式为________。
(2)下列对相关反应类型的判断合理的是________(填序号)。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:_____________________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有________种,写出其中一种的结构简式:________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为__________________________________________。
②写出反应Ⅴ的化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第10讲金属元素化合物练习卷(解析版) 题型:选择题
某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中无沉淀生成,则X是( )。
A.SiO2 B.Al2O3
C.MgO D.CuO
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题9常见金属元素及其重要化合物练习卷(解析版) 题型:填空题
下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题:

(1)请写出反应①的化学方程式_____________________________________。
(2)检验D溶液中Y离子的方法是__________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式______________________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为________kg。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题8电化学原理练习卷(解析版) 题型:选择题
利用如图装置可以模拟铁的电化学防护。下列叙述正确的是 ( )。

A.铁被腐蚀过程实质是金属铁发生了还原反应
B.若X为锌片,开关K置于M处,可减缓铁的腐蚀
C.若X为碳棒,开关K置于M处,可减缓铁的腐蚀
D.当K置于N处时,可减缓铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是____________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com