
现有部分短周期主族元素的性质或原子结构如下表所示:
| 元素编号 | 元素性质或原子结构 |
| X | 周期序数=主族序数=原子序数 |
| Y | 原子最外层电子数为a,次外层电子数为b |
| Z | 原子L层电子数为a+b,M层电子数为a-b |
| M | 单质在自然界中的硬度最大 |
| N | 位于第三周期,最外层电子数是电子层数的2倍 |
(1)写出X、Y、Z、N四种元素的名称:X_______________,Y______________,Z______________,N____________。
(2)由X、Y、Z、M、N五种元素两两组成的分子中,许多分子含有的电子数相等,写出符合下列要求的分子式:
①含10e-且呈正四面体结构的分子__________;
②含14e-的双原子分子__________;
③含16e-且能使溴水褪色的分子__________;
④含18e-且常温下呈液态的分子__________。
科目:高中化学 来源: 题型:
如图所示,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。表中对实验现象的描述或解释不正确的是( )

| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
填空
(1)有5种单核粒子,它们分别是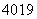 □、
□、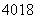 □、
□、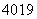 □+、
□+、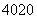 □2+、
□2+、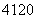 □(“□”内元素符号未写出),则它们所属元素的种类有______种。
□(“□”内元素符号未写出),则它们所属元素的种类有______种。
(2)1H、2H、3H三种微粒都属于________,因为它们是具有相同______________的同一类原子。
(3)在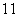 H、
H、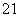 H、
H、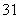 H、
H、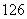 C、
C、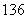 C、
C、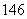 C、
C、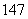 N、
N、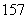 N中,核素、元素的种数分别为______种、______种。
N中,核素、元素的种数分别为______种、______种。
(4)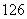 C、
C、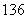 C、
C、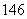 C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
C的关系为__________,因为它们是具有____________________的同一元素的不同原子。其化学性质几乎完全相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
铱192是一种放射性金属元素,铱192探伤机因其体积小、轻便、无需电源与水源、灵敏度高、性能稳定、曝光角度大可检查机械设备本身是否有裂纹或内部损害,在建筑、电力等领域使用比较广泛。下列关于铱192( 77Ir)的说法错误的是( )
77Ir)的说法错误的是( )
A.质子数为77
B.中子数与质子数差为38
C.铱191和铱193无放射性,铱192是在核反应堆中照射含有铱191和铱193的铱丝、圆片或大块而得到的,该核反应是化学变化
D.铱192与铱191、铱193互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
X是第三周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.X最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情,病毒学研究同时证实,NO对SARS病毒有直接抑制作用。下列关于NO的叙述正确的是( )
A.NO是一种红棕色气体
B.常温常压下,NO不能与空气中的氧气直接化合
C.含等质量的氧元素的NO和CO的质量相等
D.NO难溶于水,可以用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
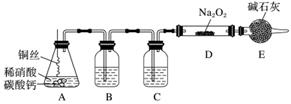
某化学活动小组想通过如图所示装置(夹持装置已略去)进行实验,探究Na2O2与NO反应的产物。
实验前,他们查阅有关资料得到如下信息:
①2NaNO3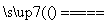 2NaNO2+O2↑;
2NaNO2+O2↑;
②NaNO2为白色粉末状固体,既有氧化性又有还原性;
③NaNO2溶液显弱碱性(原因:强碱弱酸盐的水解)。
实验开始时,先在A装置中加入适量的碳酸钙和足量稀硝酸,当不再有气体产生时,将铜丝插入稀硝酸中。
请回答下列问题:
(1)A装置中放入碳酸钙的目的是__________________。
(2)装置B、C中的试剂分别是B________、C________,E的作用是________________。
(3)如何检验反应中是否有氧气生成?______________。
(4)假如Na2O2已反应完全,为确定D中固体产物的成分,甲同学将固体溶于水后,经测定发现溶液呈强碱性,再向溶液中加入酸性高锰酸钾溶液,紫色褪去。由此现象推断固体产物中可能含有的物质是________________________________________(填化学式)。
(5)乙同学取适量固体产物于试管中密闭加热,发现白色固体部分变为淡黄色。此现象说明固体产物中还可能含有的成分是__________________(填化学式)。根据以上推测,写出Na2O2与NO反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有Fe2+、Al3+、Ag+、Cu2+,为了分别得到各含一种金属阳离子的沉淀,可采取:①通入H2S;②通入CO2;③加HCl溶液;④加NaOH溶液4个步骤,设试剂均过量,且每次都把所生成的沉淀过滤出来。其正确的操作顺序是( )
A.③①④② B.①③④②
C.④②①③ D.④②③①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com