
【题目】在水溶液中,下列电离方程式正确的是( )
A.CaCl2===Ca2++Cl2B.Na2SO4=== Na++![]()
C.HNO3=== H++![]() D.NaHCO3===Na++H++
D.NaHCO3===Na++H++![]()
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A. v(A)=0.5mol/(L·s)B. v(B)=0.3mol/(L·s)
C. v(C)=0.8mol/(L·s)D. v(D)=1.0mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镁能分别与O2、N2、CO2反应,反应的化学方程式分别是 2Mg+O2![]() 2MgO、3Mg+N2
2MgO、3Mg+N2![]() Mg3N2、2Mg+CO2
Mg3N2、2Mg+CO2![]() 2MgO+C。把等质量的金属镁分别放在:①足量纯氧气中;②足量二氧化碳气体中;③足量空气中,完全燃烧后,得到的固体物质的质量分别对应的是W1g、W2g和W3g。以下三者的关系正确的是( )
2MgO+C。把等质量的金属镁分别放在:①足量纯氧气中;②足量二氧化碳气体中;③足量空气中,完全燃烧后,得到的固体物质的质量分别对应的是W1g、W2g和W3g。以下三者的关系正确的是( )
A.W1>W2>W3B.W3=W1>W2C.W3>W2>W1D.W2>W1>W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入NO2,发生反应2NO2(g)![]() N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
N2O4(g)。其它条件相同时,不同温度下平衡体系中各物质的物质的量分数如下表:(已知:N2O4为无色气体)
t/℃ | 27 | 35 | 49 | 70 |
NO2% | 20 | 25 | 40 | 66 |
N2O4% | 80 | 75 | 60 | 34 |
下列说法不正确的是( )
A.27℃,该平衡体系中的NO2转化率为![]()
B.平衡时,NO2的消耗速率为N2O4消耗速率的2 倍
C.室温时,将盛有NO2的密闭玻璃球放入冰水中其颜色会变浅
D.其他条件不变,增大NO2起始量,平衡正移,该反应的化学平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有Fe2+、Fe3+,分别表示为 Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用 H2消除酸性废水中的致癌物 NO2-,其反应过程示意图如图所示,下列说法不正确的是
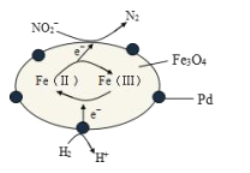
A.用该法处理后水体的 pH降低
B.Fe(Ⅱ)与 Fe(Ⅲ)的相互转化起到了传递电子的作用
C.反应过程中NO2-被 Fe(Ⅱ)还原为 N2
D.Pd 上发生的电极反应为:H2- 2e-== 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设氯原子的质量为ag,12C原子的质量为bg,用NA表示阿伏加德罗常数的值,则下列说法不正确的是( )
A.该氯原子的相对原子质量为![]() B.mg该氯原子的物质的量为
B.mg该氯原子的物质的量为![]() mol
mol
C.该氯原子的摩尔质量是aNAgD.ng该氯原子所含的电子数是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多
B. 工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
C. 久置氯水pH变小
D. Fe(SCN)3溶液中加入KSCN后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol·L1二元弱酸H2A溶液中加入氢氧化钾固体改变溶液的pH,溶液中的H2A、HA、A2的物质的量分数![]() (X)随pH的变化如图所示[已知
(X)随pH的变化如图所示[已知![]() (X) =
(X) =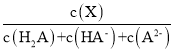 ]。下列叙述错误的是
]。下列叙述错误的是
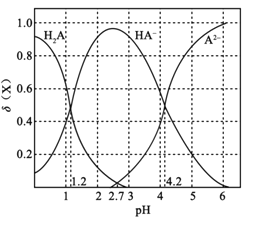
A.pH=1.2时,c(K+)+c(H+)=c(H2A)+c(OH)
B.常温下,H2A的电离平衡常数Ka2=1042
C.pH=2.7时,c(HA)>c(H2A)=c(A2)
D.KHA溶液中离子浓度为c(K+)>c(HA)>c(OH)>c(H2A)>c(H+)>c(A2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com