
| A. | 原子半径:r(X)>r(Y)>r(Z)>r(W) | |
| B. | X的简单气态氢化物的稳定性比W的弱 | |
| C. | X分别与Y、W形成的化合物中化学键类型相同 | |
| D. | Y的最高价氧化物对应的水化物碱性比Z的强 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X-、Y2+与Ne原子电子层相同,则X为F元素、Y为Mg,Z是金属,原子序数大于Mg,故Z为Al,W元素处于第三周期,其最外层电子数是内层电子总数的一半,则最外层电子数为$\frac{1}{2}$×(2+8)=5,则W为磷元素.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X-、Y2+与Ne原子电子层相同,则X为F元素、Y为Mg,Z是金属,原子序数大于Mg,故Z为Al,W元素处于第三周期,其最外层电子数是内层电子总数的一半,则最外层电子数为$\frac{1}{2}$×(2+8)=5,则W为磷元素.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径r(Mg)>r(Al)>r(P)>r(F),故A错误;
B.非金属性X(F)>W(P),非金属性越强,氢化物越稳定,故氢化物稳定性HF>PH3,故B错误;
C.F与Mg形成MgF2,含有离子键,而F与P元素形成共价键,故C错误;
D.由于金属性Y(Mg)>Z(Al),故氢氧化镁的碱性比氢氧化铝的强,故D正确,
故选D.
点评 本题考查原子结构与元素性质、元素周期律等,推断元素是解题关键,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解 | |
| B. | 反应后,溶液中NH4+,Fe2+,SO42-的物质的量减少,而Al3+、Cl-的物质的量不变 | |
| C. | Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化 | |
| D. | 该实验中共有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
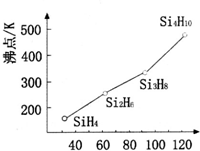 太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.
太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2和CH3CH2C1都属于烃 | B. | 乙烯和乙烷都能发生加聚反应 | ||
| C. | 米酒变酸的过程涉及氧化反应 | D. | 未成熟的苹果遇碘水不会变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价为+6 | B. | 简单离子半径的大小顺序:X>Y>Z | ||
| C. | 简单气态氢化物的稳定性:X>Y | D. | 元素X和Y能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
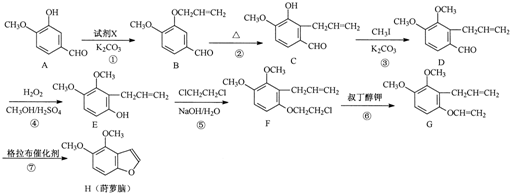
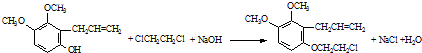 .
.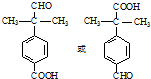 .
.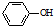 为原料制备
为原料制备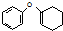 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3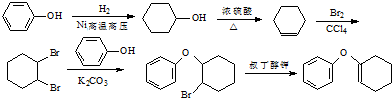 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验设计 |
| A | 检测溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| B | 除去CO2中的HCl | 通过饱和的NaHCO3溶液,然后干燥 |
| C | 除去乙酸乙酯中的乙酸 | 加入足量的NaOH溶液,然后分液 |
| D | 证明H2CO3酸性比H2SiO3强 | Na2CO3和SiO2在高温下熔融反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| B. | Na2CO3溶液:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) | |
| C. | 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | P4和CH4都是正四面体型结构的分子,且键角都为109°28ˊ | |
| C. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 | |
| D. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com