
| A. | 标准状况下,密度为d g/L的某气体纯净物一个分子的质量为$\frac{22.4}{{N}_{A}}$g | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| C. | 25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子 | |
| D. | 4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子 |
分析 A、标准状况下,密度为dg/L的某气体纯净物摩尔质量=22.4dg/mol;
B、求出甲基的物质的量,然后根据1mol甲基(-14CH3)中含8mol中子来分析;
C、pH=13的氢氧化钠溶液中,氢氧根的浓度为0.1mol/L;
D、求出钠的物质的量,然后根据钠反应后变为+1价来分析.
解答 解:A、标准状况下,密度为dg/L的某气体纯净物摩尔质量为22.4dg/mol,一个分子的质量为$\frac{22.4d}{{N}_{A}}$g,故A正确;
B、17g甲基的物质的量为1mol,而1mol甲基(-14CH3)中含8mol中子,故含8NA个,故B错误;
C、pH=13的氢氧化钠溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中含氢氧根的物质的量为n=CV=0.1mol/L×1L=0.1mol,个数为0.1NA个,故C错误;
D、4.6g钠的物质的量为0.2mol,而钠反应后变为+1价,故0.2mol钠反应后转移0.2NA个电子,故D正确.
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸用量偏大,生成CO2气体的量偏大 | |
| B. | 盐酸用量偏大,生成CO2气体的量偏小 | |
| C. | 盐酸用量偏小,生成CO2气体的量偏大 | |
| D. | 盐酸用量偏小,生成CO2气体的量偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
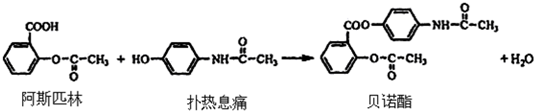
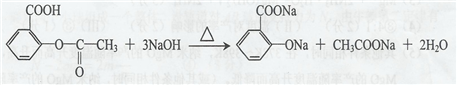 .
.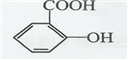 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | V1 | 20 |
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他条件与实验①相同,进行对比实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH 溶液体积/mL | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.75 | 15.50 | 23.25 |
| 氨气质量/g | 1.87 | 1.87 | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明陶瓷材料硒化锌 | B. | 半导体材料砷化镓 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 分子间作用力的大小--分子稳定性的高低 | |
| C. | 可逆反应向正方向进行的程度--电离常数的大小 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6Cl2的同分异构体有3种 | |
| B. | 分子式为C5H12O,且能与金属钠反应的同分异构体有8种 | |
| C. | 分子式为C4H8O2属于羧酸类的同分异构体有2种 | |
| D. | 分子式为C4H8O2属于酯类的同分异构体有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3是共价化合物 | |
| B. | 羟基既含有共价键又含有离子键 | |
| C. | O2分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | SO2是分子晶体,其溶于水生成亚硫酸的过程只需克服分子间作用力 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com