
分析 (1)首先根据实验步骤中的各步操作,确定所需的实验仪器,将盛有试样的坩埚加热需要坩埚钳、酒精灯等,而这些仪器在试题所提供的仪器中并没有出现,因此可确定它们是所缺少的实验用品;
(2)为了保证称量准确,步骤②有错误,应先将称量的试样放入研钵中研细,再放回到坩埚中称重;
(3)本实验为定量实验,对准确性的要求较高.在加热后冷却时,为了防止硫酸钠吸水,应将硫酸钠放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸钠;
(4)将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量,重复本操作,直至两次称量结果不变,这是为了确定样品中结晶水已经被全部除去;
(5)在测定中若被测样品中含有加热易挥发的杂质或实验前坩埚未完全干燥或者加热时有硫酸钠损失,都会造成测量结果偏高.
解答 解:(1)根据实验步骤,将盛有试样的坩埚加热需要坩埚钳、酒精灯,而这些仪器在试题所提供的仪器中并没有出现,故答案为:坩埚钳、酒精灯;
(2)为了保证称量准确,步骤②有错误,应先将称量的试样放入研钵中研细,再放回到坩埚中称重,故答案为:步骤②有错误,应先将试样研细,后放入坩埚称重;
(3)在加热后冷却时,为了防止硫酸钠吸水,应将硫酸钠放在干燥器中进行冷却,从而得到纯净而干燥的无水硫酸钠,所以硫酸钠不能放置在空气中冷却的原因是因硫酸钠放置在空气中冷却时,会吸收空气中的水分;故答案为:因硫酸钠放置在空气中冷却时,会吸收空气中的水分;
(4)实验中的加热、冷却、称量的操作步骤要重复进行,直至两次称量结果不变,这是为了确定样品中结晶水已经被全部脱去,这样做是为了保证定量实验的准确性.故答案为:保证样品中的结晶水已经全部脱去;
(5)A、被测样品中含有加热不挥发的杂质会导致测定的水的质量偏小,故A错误;
B、被测样品中含有加热易挥发的杂质会导致测定结果偏大,故B正确;
C、实验前被测样品已有部分失水会导致测定的水的质量偏小,故C错误;
D、加热前所用的坩埚未完全干燥,加热后水挥发,导致水的质量测定结果偏大,故D正确;
E、晶体加热脱水不完全,会导致测定的水的质量偏小,故E错误;
F、加热时有晶体溅出,导致水的质量测定结果偏大,故F正确.
故答案为:BDF.
点评 本题考查了硫酸钠晶体中结晶水含量的测定,题目难度不大,注意掌握测定硫酸钠晶体结晶水含量的方法,明确实验过程中恒重称量的意义及硫酸钠晶体中结晶水的计算方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
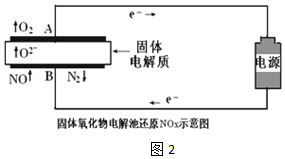
| 实验序号 | B极气体 | 电路中通过电子 | 消耗总电能 | 生成N2 |
| 实验1 | NO | 1mol | a KJ | 0.25mol |
| 实验2 | NO和空气 (不考虑NO2) | 1mol | a KJ | 0.09mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 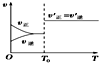 反应H2(g)+I2(g)?2HI(g)达到平衡后,升高温度时反应速率随时间的变化 | |
| B. | 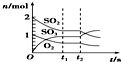 反应2SO2(g)+O2(g)?2SO3(g)达到平衡后,缩小容器容积时各成分的物质的量随时间的变化 | |
| C. |  反应N2(g)+3H2(g)?2NH3(g)在恒温条件下,反应速率与压强的关系 | |
| D. |  反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
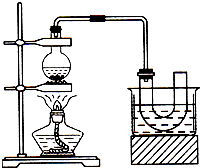 实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):
实验室制备溴乙烷(C2H5Br)的装置和步骤如图(已知溴乙烷的沸点38.4℃):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤①③④ | B. | ①③⑤②④ | C. | ①②③④⑤ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
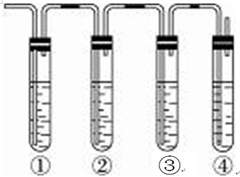 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计下列实验确认上述混合气体中有乙烯和二氧化硫.A.品红溶液 B.NaOH溶液 C.浓硫酸 D.高锰酸钾酸性溶液.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com