
下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的H2SO4溶液中:c(H+)=10-3mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-)
C.在Na2CO3溶液中,2c(Na+)= c(CO32-)+ c(HCO3-) + c(H2CO3)
D.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
A
【解析】
试题分析:A.H2SO4是强酸,完全电离,若H2SO4溶液pH=3,则c(H+)=10-3mol/L,正确;B.根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于醋酸和醋酸钠的混合溶液呈中性,所以c(H+)=c(OH-),故c(Na+)=c(CH3COO-),错误;C.在Na2CO3溶液中,根据物料守恒可得c(Na+)=2 c(CO32-)+ 2c(HCO3-) + 2c(H2CO3),错误;D.氯化铵是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,破坏了水的电离平衡,最终当溶液达到电离平衡时,c(H+)>c(OH-);根据物料守恒可得c(Cl-)=c(NH4+)+c(NH3·H2O),所以在氯化铵溶液中,:c(Cl-)>c(NH4+)>c(H+)>c(OH-),错误。
考点:考查溶液中离子浓度的大小比较的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值。下列说法正确的是()
A.标准状况下,2.24 L 水中所含的电子数为NA
B.常温常压下,16 g O3所含的电子数为8NA
C.0.1 mol Na2O2 晶体中所含的离子数为0.4NA
D.1 mol Fe在氧气中充分燃烧失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)香兰素( )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:
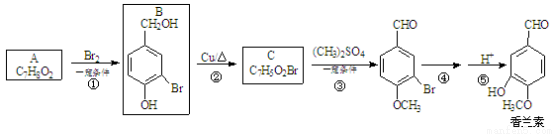

(1)写出A的结构简式 ,反应③的反应类型是______________。
(2)写出反应④的化学方程式_______________________________(不用注明条件)。
(3)1 mol香兰素在一定条件下与H2发生反应,最多消耗H2_________mol。
(4)D与香兰素互为同分异构体,能与NaHCO3溶液反应放出气体,遇FeCl3溶液显紫色,且苯环上的一氯取代物只有2种,请写出D的结构简式____ __ ___。
(5)香兰素的另一种同分异构体结构简式为 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_____ _____。
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_____ _____。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液: Na+、K+、C6H5O-、HCO3-
B.0.1mol?L-1Na2CO3 溶液:K+、Ba2+、NO3-、Cl-
C.0.1mol?L-1FeCl3 溶液:K+、NH4+、I-、SCN-
D.使甲基橙变红色的溶液: K+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届广东省深圳市高三上学期第一次五校联考理综化学试卷(解析版) 题型:推断题
(16分)乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛热。合成原理是:

(1)水杨酸中含氧官能团的名称是 ,有关水杨酸的说法,正确的是 。
A.遇 FeCl3溶液可能显紫色
B.可发生酯化反应和水解反应
C.能与溴水发生取代反应和加成反应
D.1mol水杨酸最多能与3molH2发生加成反应
(2)水杨酸与乙酸酐反应的反应类型是 。
(3)乙酰水杨酸的分子式为 ,1mol乙酰水杨酸最多能与 molNaOH反应。
(4)虚框中为提纯,是为了除去该反应的副产物:水杨酸、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物等请写出乙酰水杨酸粗品中加入饱和Na2CO3溶液发生的主要化学反应方程式为: _____ 。
(5)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式: 。
Ⅰ.能遇FeCl3溶液显紫色 Ⅱ.苯环上只有一种一溴取代物
Ⅲ.能发生银镜反应 Ⅳ. 1mol该化合物能分别与1molNaOH和2mol金属钠反应
(6) 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
。
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:填空题
(16分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:

已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有 (写一种)。
碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第一次调研考试化学试卷(解析版) 题型:选择题
在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是
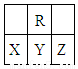
A.原子半径大小:X >Y>Z
B.氢化物的稳定性:X >Y
C.化合物YR2能使品红溶液褪色
D.X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市海珠区高三8月摸底考试理综化学试卷(解析版) 题型:填空题
(16分)已知2SO2(g)十O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
请回答下列问题:
(1)1mol SO2(g)氧化为1mol SO3(g)放出的热量为99.00kJ·mol-1,写出该反应的热化学方程式 。
(2)①在图中标出该反应的活化能E和反应热△H;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低,请在图中画图表示出来,并进行必要的标注。
(3)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是 。
A.容器中气体总压强不变 B.容器中混合气体的密度不变
C.每生成1mol SO3的同时生成1molSO2 D.SO2、O2、SO3的物质的量之比为2∶1∶2
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,测得还有0.08mol SO2剩余,求该反应的平衡常数(要求写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三九月份化学月考试卷(解析版) 题型:选择题
某周期ⅡA族元素的原子序数为x,则同周期的Ⅲ族元素的原子序数是
A.只有x+1 B.可能是x+8或x+18 C.可能是x+2 D.可能是x+1或x+11或x+25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com