
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
分析 (1)该反应是一个反应前后气体体积增大的吸热反应,升高温度、减小压强、减少生成物的量都能使平衡向正反应方向移动;
(2)利用盖斯定律构造目标热化学方程式,反应热也进行相应的运算;
(3)依据原电池原理分析,燃料电池是燃料在负极失电子发生氧化反应,正极是氧气得到电子发生还原反应,依据电解质溶液时酸性溶液书写电极反应;
(4)①正反应放热,降温时平衡正向移动;
②平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$;
③反应前后气体体积不变,等比例加入反应物,平衡与原平衡等效.
解答 解:(1)A.增加碳的用量,浓度不变,平衡不移动,故错误;
B.升高温度,平衡正向移动,H2产率增大,故正确;
C.用CO吸收剂除去CO,平衡正向移动,H2产率增大,故正确;
D.加入催化剂,平衡不移动,故错误;
故选:BC;
(2)已知:①C(s)+H2O(g)?CO(g)+H2(g),△H=+131.3kJ•mol-1,
②C(s)+CO2(g)?2CO(g),△H=+172.5kJ•mol-1
根据盖斯定律,①-②得:CO(g)+H2O(g)?CO2(g)+H2(g),△H=131.3kJ•mol-1-172.5kJ•mol-1=-41.2kJ•mol-1,
故答案为:-41.2kJ•mol-1;
(3)甲醇是一种燃料,可利用甲醇设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨做电极,负极电极反应为:CH3OH?6e-+8OH-═CO32-+6H2O
故答案为:CH3OH(g)+H2O-6e-=CO2+6H+;
(4)①正反应放热,降温时平衡正向移动,v(正)>v(逆),故答案为:<;
②CO和H2O反应了0.06mol,则CO2和H2生成了0.06mol,平衡时各物质的浓度为:反应物CO和H2O为0.05mol/L,生成物CO2和H2为0.03mol/L,平衡常数表达式为K=$\frac{生成物浓度的幂次方}{反应物浓度的幂次方}$=$\frac{0.03mol/L×0.03mol/L}{0.05mol/L×0.05mol/L}$=$\frac{9}{25}$,故答案为:$\frac{9}{25}$;
③反应前后气体体积不变,与原平衡等比例加入反应物,平衡与原平衡等效,所以,平衡时各物质的浓度与原判断相同,故答案为:不变.
点评 本题主要考查了平衡移动、盖斯定律应用、平衡常数的计算、等效平衡,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下SO3是液体 | |
| B. | 标准状况下,1 mol SO3的体积约为22.4L | |
| C. | SO3与CaO反应生成CaSO3 | |
| D. | SO2遇空气即生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾[KAl(SO4)2•12H2O]溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
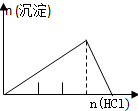 | 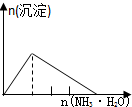 | 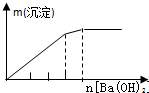 | 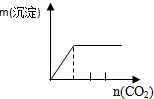 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液 | B. | Ba(OH)2溶液 | C. | H2SO4溶液 | D. | HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和NaHCO3溶液中通入过量CO2:CO32-+CO2+H2O═HCO3- | |
| B. | 金属铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | Ca(OH)2溶液与Na2CO3溶液反应:Ca2++CO32-═CaCO3↓ | |
| D. | 氯化铝与过量氨水反应:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 萃取 | C. | 液体过滤 | D. | 升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 不同时间各物质的物质的量/mol | ||||
| 0min | 2min | 4min | 6min | |
| CH4 | 2.00 | 1.76 | 1.60 | n2 |
| H2 | 0.00 | 0.72 | n1 | 1.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
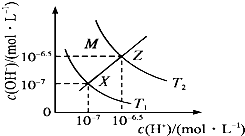
| A. | 由X→Z,c(OH-)增大,所以可以通过加碱来实现 | |
| B. | M区域内任意点均有c(H+)<c(OH-) | |
| C. | T1与T2两条曲线之间的任意点均有c(H+)×c(OH-)=10-14 | |
| D. | XZ线表示c(H+)=c(OH-),溶液显中性,所以XZ线上任意点均有pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com