
在标准状况下,将537.6L氯化氢气体溶于水配成2L溶液,试计算:
⑴该盐酸的物质的量浓度是多少?
⑵8.7gMnO2与100mL该盐酸反应,生成的气体在标准状况下是多少升?
⑶向反应后的溶液中加入足量的AgNO3溶液,可生成沉淀的物质的量是多少?
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
 (选做题)
(选做题)| 45V |
| 28 |
| 45V |
| 28 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省盟校十校联考高三第一次联考理综化学试卷(解析版) 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
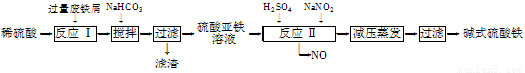
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是????????????????????????? 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是???????????????????????? 。
(3)反应Ⅱ的离子方程式为????????????????????????? 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作????????? 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为??????????????? 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为????????????????????????????????????????????????? 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为??????? 。
A.氯水??? ? B.KSCN溶液??? ? C.NaOH溶液??? ? D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为??????? 。
A.22.1 g?????? B.27.2 g???????? C.30 g?????????? D.无法确定
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市静安区高三上学期期末考试化学试卷(解析版) 题型:计算题
(1)900 K时,用足量的H2与钠钾合金10.10 g充分反应,得到10.40g白色的氢化物混合物,则该钠钾合金的化学式为____________。
(2)将l.56 g Na2O2加入20.00g水中,充分反应后,所得溶液的质量分数为________(保留3位小数,用百分数表示保留l位小数);25℃时NaOH的溶解度为53.00 g/100g水,则将该溶液蒸发_______g水后恢复至25℃可得饱和溶液(保留2位小数)。
(3)取10.00 gNaNO3加热,得到的固体中Na的质量分数为31.51%,则氧的质量分数为_________(保留2位小数)。
(4)某碱金属R与汞的合金2.4g加入足量水中,充分反应后,收集到气体l.12 L(标准状况),则可推导出R元素是________(写元素符号)。
(5)在l.12 L密闭容器中,将KOH与O3在一定条件下反应,得到气体(只含一种元素)、固体物质A和KOH·H2O。有关实验数据如下:
|
KOH |
O3 |
A |
KOH·H2O |
气体密度 |
|
16.8 g |
0.3 mol |
a g |
b g |
>1.429 g/L |
|
16.8 g |
0.2 mol |
a g |
b g |
1.429 g/L |
A会缓慢分解产生一种钾的氧化物和O2。试确定A的化学式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com