
第三研究性学习小组发现某一种胃药片的制酸剂为碳酸钙,为了测定其中制酸剂的质量特制定了如下操作步骤:
①配制0.2 mol·L-1的HCl溶液和0.2 mol·L-1的NaOH溶液;②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后放入锥形瓶中再加入20 mL蒸馏水;③以酚酞作指示剂,用0.2 mol·L-1的NaOH溶液滴定,需用去V mL达滴定终点;④加入25 mL 0.2 mol·L-1的HCl溶液。
(1)写出全部实验过程的操作步骤的顺序:____________。

(2)上图所示的仪器中配制0.2 mol·L-1的HCl溶液和0.2 mol·L-1NaOH溶液肯定不需要的仪器是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(3)配制上述溶液应选用的容量瓶的规格分别为________(填字母)。
A.50 mL、50 mL B.100 mL、100 mL
C.100 mL、150 mL D.250 mL、250 mL
(4)写出相关的化学反应方程式:
________________________________________________________________________。
(5)做2次平行实验后,则每粒胃药片中含碳酸钙的质量表达式为________________g。
(1)①②④③②④③或②①④③②④③
(2)AC 烧杯、玻璃棒 (3)B
(4)CaCO3+2HCl===CaCl2+CO2↑+H2O、HCl+NaOH===NaCl+H2O
(5)0.25-
【解析】
试题分析:(1)要检测碳酸钙的含量,则需要利用碳酸钙和盐酸,然后再通过中和滴定测出剩余盐酸的物质的量即可得出碳酸钙的含量,所以正确的顺序是①②④③②④③或②①④③②④③。
(2)根据配制原理可知,烧瓶和分液漏斗在钙实验中是不需要的,答案选AC。另外还缺少烧杯和玻璃棒。
(3)碳酸钙的质量最多是0.2g,则消耗盐酸的物质的量最多是 ,实验需要盐酸的体积是0.004mol÷0.2L/mol=0.02L=20ml,由于至少要做2次实验,因此需要的盐酸体积应该大于50ml,所以应该配制100ml溶液,答案选B。
,实验需要盐酸的体积是0.004mol÷0.2L/mol=0.02L=20ml,由于至少要做2次实验,因此需要的盐酸体积应该大于50ml,所以应该配制100ml溶液,答案选B。
(4)相关的化学反应方程式是CaCO3+2HCl===CaCl2+CO2↑+H2O、HCl+NaOH===NaCl+H2O。
(5)被氢氧化钠中和的盐酸是0.0001(V1+V2)mol,则和碳酸钙反应的盐酸是0.005mol-0.0001(V1+V2)mol,则碳酸钙的物质的量是0.0025-0.00005(V1+V2)mol,所以碳酸钙的质量是0.25g-0.005(V1+V2)g。
考点:考查仪器的选择、实验操作以及物质含量的有关计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:阅读理解
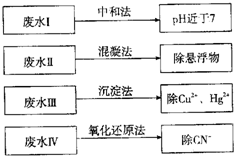 根据废水中所含有害物质的不同,工业上有多种废水的处理方法.
根据废水中所含有害物质的不同,工业上有多种废水的处理方法.| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
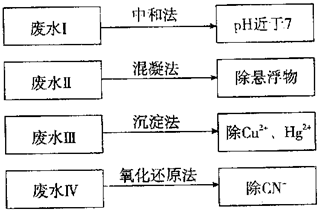
| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com