
| A、物质的量浓度相等的NH4Al(SO4)2、NH4HCO3、NH4Cl溶液中c(NH4+):NH4HCO3>NH4Cl>NH4Al(SO4)2 |
| B、1.0mol?L-1Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、测得酸式盐NaHA溶液的PH=3,则NaHA在溶液中一定是电离大于水解 |
| D、某二元弱酸的酸式盐NaHA溶液中:c(Na+)=c(HA-)+c(H2A)+c(A2-)+c(OH-) |


科目:高中化学 来源: 题型:
 已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.
已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.| 反应 | 平衡常数(K) | 反应热(△H) | |
| 900℃ | 1100℃ | 900℃ | |
| ①Fe(s)+CO2(g) FeO(s)+CO(g) | 1.98 | 2.15 | akJ/mol |
| ②Fe(s)+H2O(g) FeO(s)+H2(g) | 1.98 | 1.47 | |
| ③CO(g)+H2O(g)CO2(g)+H2(g) | ckJ/mol | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
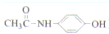 )(以下简称X)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧和关节痛、神经痛、偏头痛等病症,它可用如下方法来合成
)(以下简称X)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧和关节痛、神经痛、偏头痛等病症,它可用如下方法来合成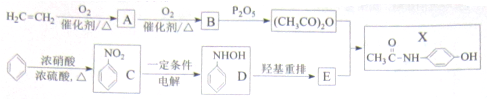
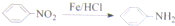 .请回答下列问题:
.请回答下列问题: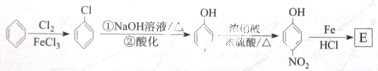
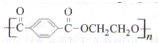 .请设计合成路线(无机试剂及溶剂任选)
.请设计合成路线(无机试剂及溶剂任选)查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向某浓度H2A溶液中逐滴加入一定量浓度NaOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是( )
常温下,向某浓度H2A溶液中逐滴加入一定量浓度NaOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数与溶液pH的关系如图所示,则下列说法中不正确的是( )| A、H2A是一种二元弱酸 |
| B、常温下,H2A=H++HA-的电离平衡常数Ka1=0.01 |
| C、将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液pH一定为5.5 |
| D、在量热计中,用20.0mL0.10mol/LnaOH溶液,分别与10.0mL0.20mol/LH2A和20.0mL0.10mol/LH2A反应后放出的热量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4种溶液pH的大小顺序:①>④>③>② |
| B、溶液①、②等体积混合后pH>7,则c(NH4+)<c(NH3?H2O) |
| C、向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>② |
| D、向溶液③、④中分别加入25mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
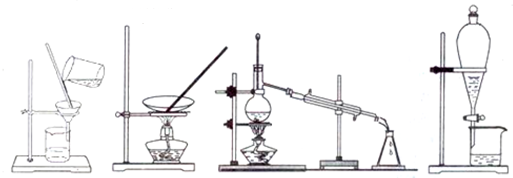
| A、蒸发、蒸馏、蒸发、过滤分液 |
| B、过滤、蒸馏、蒸发、萃取分液 |
| C、蒸发、蒸馏、过滤、萃取分液 |
| D、过滤、蒸发、蒸馏、萃取分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ | ||
| B、Fe2+ | ||
| C、Al3+ | ||
D、N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com