
①漆酚![]()
②丁香油酚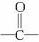
③白藜芦醇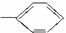
④莪术根茎中的色素![]()
(1)各自消耗的Br2的最大用量是①__________;②__________;③__________;④__________。
(2)各自消耗H2的最大用量是①__________;②__________;③__________;④__________。
解析:根据有机物的官能团决定有机物的性质,Br2水与苯,![]() 不发生反应,而Br2水可以与—CH=CH—,—C≡C发生加成反应,而与酚发生苯环上的邻、对位取代反应。H2可与
不发生反应,而Br2水可以与—CH=CH—,—C≡C发生加成反应,而与酚发生苯环上的邻、对位取代反应。H2可与![]() ,—CH=CH—,—C≡C—,
,—CH=CH—,—C≡C—,![]() 均可发生加成反应。
均可发生加成反应。
①苯环上有3个H可被取代,—C15H27中可能存在一个—C≡C—,或者两个![]() ,所以消耗Br2的最大量是5 mol,消耗H2的最大量也是5 mol。
,所以消耗Br2的最大量是5 mol,消耗H2的最大量也是5 mol。
②根据丁香油酚的结构,可知消耗Br2的最大量为2 mol,H2的最大量为4 mol。
③白藜芦醇,可被Br2取代的氢有5个,同时又有一个![]() ,可发生加成,综合考虑白藜芦醇的结构,消耗Br2的最大量为6 mol,H2的最大量为7 mol。
,可发生加成,综合考虑白藜芦醇的结构,消耗Br2的最大量为6 mol,H2的最大量为7 mol。
④根据色素的结构知:消耗Br2的最大量为6 mol,消耗H2的最大量为10 mol。
答案:(1)①5 ②2 ③6 ④6 (2)①5 ②4 ③7 ④10


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:阅读理解
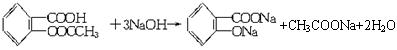 (相对分子质量为180)。已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应)。某课外学习小组为检验阿司匹林有效成分的官能团并测定其在药片中的含量,进行了如下实验:
(相对分子质量为180)。已知:阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应)。某课外学习小组为检验阿司匹林有效成分的官能团并测定其在药片中的含量,进行了如下实验: Ⅰ.验证乙酰水杨酸中具有羧基和酯的结构(—COOR)。
①将一片阿司匹林研碎后溶于水,静置,各取清液2 mL于两支洁净的试管中;
②向一支试管中加入____________,若观察到____________,即证明乙酰水杨酸中有羧基;
③向另一支试管中加入适量NaOH溶液,加热几分钟,冷却后逐滴滴入稀H2SO4,再向其中滴入FeCl3溶液,边加边振荡,若观察到溶液逐渐变为____________色,即证明乙酰水杨酸中具有酯的结构。
回答下列问题:
(1)将上述三处空白补充完整。
(2)实验中滴加稀H2SO4的作用是_____________________________________________。
Ⅱ.该学习小组设计了如下实验方案测定乙酰水杨酸在药片中的含量。
①称取阿司匹林样品m g;②将样品研碎,溶于V1 mL a mol·L-1 NaOH溶液中(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;③向锥形瓶中滴加几滴指示剂,用浓度为b mol·L-1的盐酸来滴定未反应的NaOH,消耗盐酸的体积为V2 mL。
回答下列问题:
(1)阿司匹林中加入过量NaOH溶液并加热发生反应的化学方程式为____________;其中加热目的是____________________________________________________________。
(2)步骤③中若用酚酞作指示剂,如何判断滴定终点?________________________________
____________________________________________________________________。
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为___________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年江苏省徐州市高三第三次调研考试(化学试题) 题型:填空题
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两
个选修模块的内容。请选择其中一题作答。若两题都做,则按A题评分。
A.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有lO个电子;B溶
于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物
质混合后可得D和一种白色沉淀。 离子与Ar原子的电子层结构相同。请回答:
离子与Ar原子的电子层结构相同。请回答:
(1)基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极
性分子的有 (写化学式)。
(2)下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体 b.该分子的稳定性与氢键有关
c.分子由各原子最外层均为8 。的稳定结构
。的稳定结构
d.含1 mol B的液体中有3 mol氢键
(3)根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型
是 。
(4)构成C的中心原子可以形成多种单质,其中有一种为空间网状结
构,右图立方体中心的“●”表示该晶体中的一个原子,请在该
立方体的顶点上用“●”表示出与之紧邻的原子。
(5)光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中
不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键
f.配位键 g. 键 h.
键 h. 键
键
B.对氨基苯磺酸是制取某些染料和药物的重要中间体,可由苯胺磺化得到:
实验室可用苯胺、浓硫酸为原料,利用右图所示实验装置合成。
实验步骤如下:
①取一个250mL的仪器a,加入10mL苯胺及几粒沸石,
放人冷水中冷却,小心地加入18 mL浓硫酸。再分别
装上冷凝管、温度计等。
②将a置于油浴中缓慢加热至170`180℃,维持此温度约2.5 h。
③将反应产物冷却至约50℃后,倒入盛有100  ,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
,冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出。用该烧杯中的少量冷水将a内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到粗产品。
④将粗产品用沸水溶解,冷却结晶(若溶液颜色过深,可用活性炭脱色),抽滤,收集
产品,晾干。(提示:100mL水在20℃时可溶解对氨基苯磺酸1.08 g,在100℃时可
溶解6.67 g)
(1)仪器a的名称是 。步骤①中加入沸石的作用是 。
(2)步骤②中采用油浴加热,下列说法正确的是 。(填字母)
A.便于控制温度 B.也可以改用水浴加热 C.温度计的水银球也可浸在油中
(3)步骤③用冷水洗涤的优点是 。
(4)步骤③和④均进行了抽滤操作,在抽滤完毕停止抽滤时,应注意先一二,然
后 。
(5)步骤④有时需重复进行多次,其目的是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:实验题
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(2)加入Sn粉的作用有两个:①调节溶液pH ② 。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。
(4)多步操作包含的具体实验步骤的名称可以是: 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
查看答案和解析>>
科目:高中化学 来源:2014届湖北省宜昌市高二下学期期末考试化学试卷(解析版) 题型:填空题
现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
|
阳离子 |
H+、NH4+、Mg2+、Ba2+、Al3+ |
|
阴离子 |
OH-、Cl-、HCO3-、NO3-、SO42- |
已知:①0.1 mol/L A溶液的pH <1;②将B溶液分别与其它四种溶液混合,均有白色沉淀生成;
③C溶液 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题:
(1)写出下列物质的化学式:A______________、B______________。
(2)写出“C溶液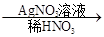 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。
(3)D、E两种物质中必有一种是_______________,写出将少量该物质的溶液滴加到B溶液中反应的离子方程式___________________________________________________________________。
(4)请你设计实验确定C及另一种未知物各是什么物质。(只许在A~E中选择检验试剂)
|
实验步骤 |
预期现象和结论 |
|
取适量C的溶液于试管中, ① 。 |
预期现象和结论1: ② ; 预期现象和结论2: ③ ; |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
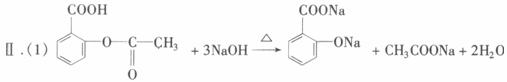
已知:①阿司匹林药片中一般添加少量的辅料(都不溶于水,也不与NaOH反应);②酚类物质与FeCl3溶液在弱酸性条件下能发生显色反应。
某课外学习小组为检验阿司匹林有效成分中的官能团并测定乙酰水杨酸在药片中的含量,进行了如下实验:
Ⅰ.验证乙酰水杨酸中具有羧基和酯的结构(—COOR)。
①将一片阿司匹林研碎后溶于水,静置,各取清液2 mL于两支洁净的试管中;
②向一支试管中加入_________,若观察到__________________,即证明乙酰水杨酸中有羧基;
③向另一支试管中加入适量NaOH溶液,加热几分钟,冷却后逐滴入稀H2SO4,再向其中滴入FeCl3溶液,边加边振荡,若观察到溶液逐渐变为_________色,即证明乙酰水杨酸中具有酯的结构。
回答下列问题:
(1)将上述三处空白补充完整。
(2)实验中滴加稀H2SO4的作用是__________________。
Ⅱ.该学习小组设计了如下实验方案测定乙酰水杨酸在药片中的含量:
①称取阿司匹林样品m g;
②将样品研碎,溶于V1 mL a mol·L-1 NaOH溶液(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
③向锥形瓶中滴加几滴指示剂,用浓度为b mol·L-1的标准盐酸返滴未反应的NaOH,消耗盐酸的体积为V2 mL。
回答下列问题:
(1)阿司匹林中加入过量NaOH溶液并加热时发生反应的化学方程式为__________________;其中,加热的目的是__________________________________________。
(2)不能将阿司匹林溶解于水后直接用NaOH溶液进行滴定的原因是_____________________
____________________________________________________________________。
(3)根据实验中记录的数据,阿司匹林药片中乙酰水杨酸质量分数的表达式为_____________
_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com