
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ/mol、283.0 kJ/mol和890.0 kJ/mol。一定条件下,CO与H2合成燃烧的热化学方程式为:CO(g)+3H2(g)=CH4(g)+H2O(l) △H,则△H=___;该反应能自发进行的原因是___。
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
反应B:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
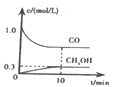
①一定温度下,在体积可变的恒压密闭容器中加入4 mol H2和一定量的CO发生反应A,开始时容器体积为2 L,CO和CH3OH(g)的浓度随时间变化如图1所示,10 min时达到平衡,则反应A的化学平衡常数为_______。(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应B已经达到平衡状态的是___(填序号)。
A. 容器内CO2的体积分数不再变化
B. 当CO2和H2转化率的比值不再变化
C. 当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H健
D. 容器内混合气体的平均相对分子质量达到34.5,且保持不变
【答案】-250.4 kJ/mol 该反应的焓变数值较大,且小于0 0.1 (L/mol)2 ABCD
【解析】
(1)写出三种物质燃烧的热化学方程式,然后根据盖斯定律计算所求反应的焓变,当△G=△H-T△S<0时,反应能自发进行;
(2)①根据图象分析,反应开始时CO浓度为1 mol/L,由于开始时容器体积为2 L,则开始时CO的物质的量是2 mol,反应达到平衡状态时c(CH3OH)=0.3 mol/L,起始时在体积可变的恒压密闭容器中加入4 mol H2和2 mol CO发生反应A:CO(g)+2H2(g)![]() CH3OH(g),根据物质反应转化关系得到平衡时各种气体的物质的量,然后假设此时容器容积为V L,利用浓度定义式和甲醇浓度,可得转化物质的量与容器体积关系式,再根据恒温恒压下气体的物质的量的比等于压强之比,计算出转化的物质的量及平衡时容器容积,进而得到平衡时各种物质的浓度,带入平衡常数表达式即可求解;
CH3OH(g),根据物质反应转化关系得到平衡时各种气体的物质的量,然后假设此时容器容积为V L,利用浓度定义式和甲醇浓度,可得转化物质的量与容器体积关系式,再根据恒温恒压下气体的物质的量的比等于压强之比,计算出转化的物质的量及平衡时容器容积,进而得到平衡时各种物质的浓度,带入平衡常数表达式即可求解;
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2 和H2,发生反应B:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),达到平衡状态时,v正=v逆,容器内混合气体的平均相对分子质量等于以g/mol为单位的平均摩尔质量,据此分析。
CH3OH(g)+H2O(g),达到平衡状态时,v正=v逆,容器内混合气体的平均相对分子质量等于以g/mol为单位的平均摩尔质量,据此分析。
(1) H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ/mol、283.0 kJ/mol和890.0 kJ/mol。
①H2(g)+![]() O2(g)= H2O(l)△H1=-285.8 kJ/mol
O2(g)= H2O(l)△H1=-285.8 kJ/mol
②CO(g)+![]() O2(g)= CO2(g)△H2=-283.0 kJ/mol
O2(g)= CO2(g)△H2=-283.0 kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H3=-890.0 kJ/mol
将①×3+②-③,整理可得:CO(g)+3H2(g)=CH4(g)+H2O(l)△H =3△H1+△H2-△H3=-250.4 kJ/mol,
当△G=△H-T△S<0时,反应能自发进行,该反应中焓变数值较大且小于0,所以能自发进行;
(2)①根据图象分析,反应达到平衡状态时c(CH3OH)=0.3 mol/L,起始时在体积可变的恒压密闭容器中加入4 mol H2和一定量的CO发生反应A:CO(g)+2H2(g)![]() CH3OH(g),开始时容器体积为2 L,根据理想气体状态方程pV=nRT,则有p=cRT,由于反应为恒压容器,所以始末态体系压强相等,根据图象可知在反应开始时c(CO)=1 mol/L,则开始时n(CO)=1 mol/L×2 L=2 mol,n(H2)=4 mol,假设反应过程在反应产生CH3OH的物质的量为x,则反应消耗CO为x mol,消耗H2为2x mol,所以平衡时CO为(2-x)mol,H2为(4-2x)mol,CH3OH为x mol,假设平衡时容器的容积为V L,则
CH3OH(g),开始时容器体积为2 L,根据理想气体状态方程pV=nRT,则有p=cRT,由于反应为恒压容器,所以始末态体系压强相等,根据图象可知在反应开始时c(CO)=1 mol/L,则开始时n(CO)=1 mol/L×2 L=2 mol,n(H2)=4 mol,假设反应过程在反应产生CH3OH的物质的量为x,则反应消耗CO为x mol,消耗H2为2x mol,所以平衡时CO为(2-x)mol,H2为(4-2x)mol,CH3OH为x mol,假设平衡时容器的容积为V L,则![]() =0.3 mol/L,所以x=0.3V mol,在恒温恒压下气体的物质的量的比等于压强之比,所以
=0.3 mol/L,所以x=0.3V mol,在恒温恒压下气体的物质的量的比等于压强之比,所以![]() =
=![]() ,解得V=
,解得V=![]() L,x=0.5 mol,所以平衡时c(CO)=
L,x=0.5 mol,所以平衡时c(CO)= =0.9 mol/L,c(H2)=2c(CO)=1.8 mol/L,c(CH3OH)=0.3 mol/L,故该反应的化学平衡常数K=
=0.9 mol/L,c(H2)=2c(CO)=1.8 mol/L,c(CH3OH)=0.3 mol/L,故该反应的化学平衡常数K=![]() =
=![]() (L/mol)2≈0.1(L/mol)2;
(L/mol)2≈0.1(L/mol)2;
②A. 容器内CO2的体积分数随着反应进行而变化,当容器内CO2的体积分数不再变化时,反应达到平衡状态,A正确;
B. CO2和H2的物质的量的比不等于化学计量数之比,则CO2和H2转化率的比值随着反应进行而变化,当CO2和H2转化率的比值不再变化,反应达到平衡状态,B正确;
C. 当水分子中断裂2NA个O-H键,必然会同时产生3NA个H-H键,同时氢分子中断裂3NA个H-H键,则氢气的浓度不变,正反应速率等于逆反应速率,反应达到平衡状态,C正确;
D. 容器内混合气体的质量守恒,物质的量随着反应进行而变化,混合气体的平均相对分子质量也随之变化,当混合气体的平均相对分子质量为34.5且保持不变时,反应达到平衡状态,D正确;
故合理选项是ABCD。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法不正确的是( )
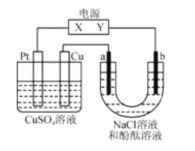
A.X极是电源正极,Y极是电源负极
B.Cu电极上增重6.4g时,b极产生4.48L(标准状况)气体
C.电解过程中CuSO4溶液的pH逐渐减小
D.a极的电极反应式为2C1--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是( )
A.2SO2+O2=2SO3 ΔH=-196.6kJ·mol-1
B.H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8kJ
O2(g)=H2O(l) ΔH=-285.8kJ
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
D.C(s)+O2(g)=CO2(g) ΔH=393.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:C8H14O4+2H2O![]() X+2CH3OH(已配平)。符合该反应的有机物X有(不考虑立体异构)( )
X+2CH3OH(已配平)。符合该反应的有机物X有(不考虑立体异构)( )
A.8种B.9种
C.10种D.12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用试纸、铅笔芯设计的微型实验。以铅笔芯为电极,分别接触表面皿上的部分交叠的两张试纸,接通电源,观察实验现象。下列说法错误的是( )
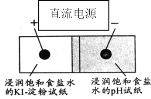
A.pH试纸变蓝
B.KI-淀粉试纸变蓝
C.此装置不属于原电池
D.电子通过pH试纸到达KI-淀粉试纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示,下列判断正确的是
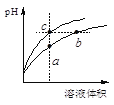
A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C.a、b、c三点溶液水的电离程度a>b>c
D.与等体积b、c处溶液反应,消耗等量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)等质量的O2和O3所含分子个数比为________,所含原子个数比为_______。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是__________(用含NA的式子表示)。
(3)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为__________。
(4)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
(5)100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后(溶液体积保持不变),溶液中SO42-的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com