
【题目】实验室测定铬铁矿中铬(Cr)含量的步骤如下:
步骤1:准确称取0.2000g铬铁矿试样放入锥形瓶中,加入适量磷酸和硫酸的混合酸,加热使试样完全溶解,冷却。
步骤2:向上述溶液中滴加5滴1%MnSO4溶液,再加入一定量的(NH4)2S2O8溶液,摇匀至溶液呈紫红色[先后发生Cr3+![]() Cr2O72-、Mn2+
Cr2O72-、Mn2+![]() MnO4-]。
MnO4-]。
步骤3:上述溶液加热煮沸至紫红色褪去[除去过量的(NH4)2S2O8和生成的MnO4-],冷却。
步骤4:用0.2000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定上述溶液至终点(发生Cr2O72-![]() Cr3+),消耗19.50mL标准溶液。
Cr3+),消耗19.50mL标准溶液。
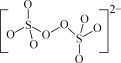
(1)(NH4)2S2O8中阴离子的结构如图所示。从结构分析,(NH4)2S2O8置于棕色试剂瓶并于阴凉处保存的原因是__。
(2)“步骤2”中加入5滴1%MnSO4溶液的目的是__。
(3)“步骤3”中,如果继续加热煮沸时间不充足,会使铬含量的测定结果___(填“偏大”“不变”或“偏小”)。
(4)计算铬铁矿中铬的质量分数___(写出计算过程)。
【答案】过氧键见光、受热易断裂而造成物质分解 判断溶液中的Cr3+是否完全被氧化成Cr2O72- 偏大 33.8%
【解析】
(1)棕色试剂瓶是存放见光易分解的物质;
(2)加入5滴MnSO4溶液的目的是作为Cr3+与(NH4)2S2O8反应的指示剂;
(3)“氧化”过程中,如果继续加热煮沸时间不充足,溶液中过量的(NH4)2S2O8和生成的HMnO4不能完全分解除去,会消耗更多(NH4)2Fe(SO4)2标准溶液;
(4)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,得到:6Fe2+~Cr2O72-,结合操作过程中的定量关系计算。
(1)从结构分析,(NH4)2S2O8置于棕色试剂瓶并于阴凉处保存的原因是过氧键见光、受热易断裂而造成物质分解。
故答案为:过氧键见光、受热易断裂而造成物质分解;
(2)“步骤2”中加入5滴1%MnSO4溶液的目的是作为Cr3+与(NH4)2S2O8反应的指示剂,判断溶液中的Cr3+是否完全被氧化成Cr2O72-。
故答案为:判断溶液中的Cr3+是否完全被氧化成Cr2O72-;
(3)②“氧化”过程中,如果继续加热煮沸时间不充足,溶液中过量的(NH4)2S2O8和生成的HMnO4不能完全分解除去,会消耗更多(NH4)2Fe(SO4)2标准溶液,导致计算得到结果偏大;
故答案为:偏大;
(4)根据氧化还原反应规律:亚铁离子被氧化,离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,据此得到:6Fe2+~Cr2O72-,n(Cr2O72-)=![]() ×0.20000mol·L-1×19.50mL×10-3 mL·L-1=6.5×10-4 mol,铬的质量分数=
×0.20000mol·L-1×19.50mL×10-3 mL·L-1=6.5×10-4 mol,铬的质量分数=![]() ×100%=33.8%;
×100%=33.8%;
故答案为:33.8%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某实验小组对H2O2分解反应进行实验探究:将质量相等状态不同的MnO2分别加入盛有等体积等浓度的H2O2溶液的大试管中,并用带火星的木条在试管口测试。有关记录如下:
MnO2 | 触摸试管 | 现象 | 反应时间/min |
粉末 | 发烫 | 反应剧烈,带火星的木条迅速复燃 | t1 |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | t2 |
(1)试管中化学反应方程式:____________。
(2)实验结果证明了催化剂的催化效果与____________有关。
(3)表中t1____________t2(填写“>”、“<”或“=”)
(4)控制该反应速率,除了改变催化剂因素,可行的方法还有____________。
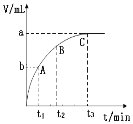
(5)某同学用一定浓度的H2O2溶液10mL,加入适量MnO2在某温度下反应,测量放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的即时反应速率最慢的是____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL浓度均为0.1 mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知CH3COOH的Ka=1.8×10-5,NH3·H2O的Kb =1.8×10-5。下列说法正确的是
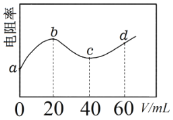
A.b→c过程发生的反应:MOH+CH3COOH=CH3COOM+H2O
B.c点溶液中:c(CH3COOH)+c(CH3COO–)=2c(NH4+)
C.d 点溶液中:c(CH3COO–)c(CH3COOH)>c(M+)>c(H+)>c(OH–)
D.a→c过程中水的电离程度一直在增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得。下列叙述正确的是( )
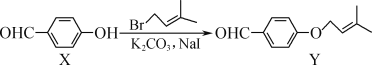
A.Y的分子式为C12H14O2
B.可用FeCl3溶液鉴别X和Y
C.Y能使酸性高锰酸钾溶液褪色可证明其分子中含有碳碳双键
D.1molX与4molH2完全加成所得产物分子中含2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H5IO6(正高碘酸)是用于光度法测定苯肼的试剂。工业上用NaIO3制备H5IO6的流程如图:
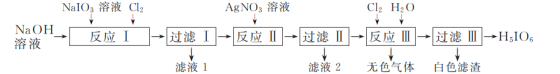
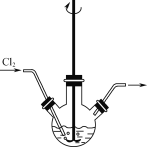
(1)“反应Ⅰ”可在如图所示的装置中进行。该反应生成不溶于水的Na2H3IO6的离子方程式为____。若要提高Cl2的利用率,可对装置进行改进的措施为___。
(2)反应Ⅱ生成不溶于水的黑色Ag5IO6,“滤液2”呈__(填“酸”“碱”或“中”)性。
(3)“无色气体”为__(填化学式)。
(4)工业上为降低成本,减少对环境的污染,整个流程需要控制加入Cl2和AgNO3的物质的量之比为n(Cl2)∶n(AgNO3)=__。
(5)H5IO6具有强氧化性,可将FeSO4氧化为H2FeO4,自身被还原为HIO3,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=___kJ·mol-1。
(2)常用脱硫剂的脱硫效果及反应条件如表,则最佳脱硫剂为___。
脱硫剂 | 出口硫/(mg·m-3) | 脱硫温度/℃ | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸汽再生 |
活性碳 | <1.33 | 常温 | 0~3.0 | 蒸汽再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锌锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生如下热分解反应:H2S(g)![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
控制不同的温度和压强进行实验,结果如图1所示。
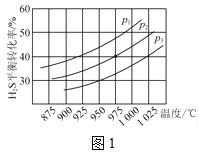
(1)p1、p2、p3由大到小的顺序为___。
()保持压强不变,能提高H2S的平衡转化率的措施有__(写一条)。
Ⅲ.间接电解法脱硫
间接电解法脱硫原理如图2所示(吸收反应器中盛放FeCl3溶液,电解反应器的阴极、阳极均为惰性电极)。
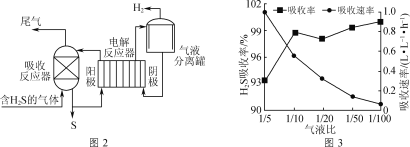
(1)吸收反应器中发生反应的离子方程式为___。
(2)反应器阴极生成H2的电极反应式为__。
(3)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图3所示。随着气液比减小,H2S的吸收率呈上升趋势的原因为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672
【解析】
(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;
②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;
③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×![]() =0.25mol,质量为40g;
=0.25mol,质量为40g;
(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;
②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为![]() ×22.4L·mol-1=0.672L=672mL。
×22.4L·mol-1=0.672L=672mL。
【点睛】
金属与硝酸反应的计算一般常采用以下方法:①原子守恒法:HNO3与金属反应时,一部分HNO3起酸的作用,以NO的形式存在于溶液中;一部分作为氧化剂转化为还原产物,这两部分中氮原子的总物质的量等于反应消耗的HNO3中氮原子的物质的量;②得失电子守恒法:HNO3与金属的反应属于氧化还原反应,HNO3中氮原子得到电子的物质的量等于金属失电子的物质的量;③电荷守恒法:HNO3过量时反应后溶液中(不考虑OH-)有:c(NO3-)=c(H+)+nc(Mn+)(Mn+代表金属离子);④离子方程式计算法:金属与H2SO4、HNO3的混合酸反应时,由于溶液中NO3-在H2SO4提供H+的条件下能继续与金属反应,因此此类题目应用离子方程式来计算,先作过量判断,然后根据完全反应的金属或H+或NO3-进行相关计算,且溶液中要符合电荷守恒。
【题型】综合题
【结束】
21
【题目】如图是氮元素的几种价态与物质类别的对应关系。请回答下列问题:

(1)写出N2的一种用途:___。
(2)HNO3与图中的物质C
(3)实验室制取物质B的化学方程式为____。
(4)NO2与水反应生成物质A的化学方程式为____。
(5)浓硝酸与木炭在加热条件下反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.用铂丝蘸取NaCl溶液置于酒精灯火焰上灼烧,火焰呈黄色 | B.将少量银氨溶液加入盛有淀粉和硫酸的试管中,加热,产生光亮的银镜 | C.饱和食盐水通电一段时间后,湿润的KI-淀粉试纸遇b处气体变蓝色 | D.将胆矾晶体悬挂于盛有浓H2SO4的密闭试管中,蓝色晶体逐渐变为白色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)上述反应中,不属于氧化还原反应的是__________(填代号,下同),H 2 O 2 仅体现还原性的反应是__________。
(2)上述反应说明H2O2 、Ag2O、K2CrO 4 氧化性由强到弱的顺序是_________________
(3)某强酸反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、MnO4— 、H2O、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2 →O2。
①反应体系选择的酸是:____________ A.盐酸 B.硫酸 C醋酸
②该反应的离子方程式为________________________________________。
③如果上述反应中有2.24L(标准状况)气体生成,转移的电子为 _______mol.
(4)H2O2 有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实验:KCN+H2O2 +H2O=A+NH3↑,试指出生成物A的化学式为_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com