
【题目】往含0.2mol NaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
A.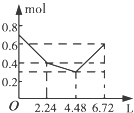
B.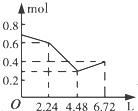
C.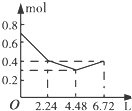
D.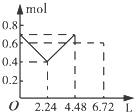
【答案】C
【解析】解:向含0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,依次发生的反应为Ba(OH)2+CO2═BaCO3↓+H2O、2NaOH+CO2═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3、BaCO3+H2O+CO2═Ba(HCO3)2 , 因此可知当通入2.24 L CO2时0.1 mol Ba2+和0.2 mol OH﹣参加反应,溶液中离子的量由起始的0.7 mol降到0.4 mol,再通入2.24 L CO2时,0.2 mol OH﹣参加反应,生成0.1 mol CO32﹣ , 溶液中离子的量由0.4 mol降到0.3 mol,最后再通入2.24 L CO2时,0.1 mol CO32﹣发生反应,生成0.2 mol HCO3﹣ , 溶液中离子的量由0.3 mol升高到0.4 mol.
故选:C.
n(CO2)= ![]() =0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中,发生:2OH﹣+CO2=CO32﹣+H2O、OH﹣+CO2=HCO3﹣+H2O、Ba2++CO32﹣=BaCO3↓,以此解答该题.
=0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中,发生:2OH﹣+CO2=CO32﹣+H2O、OH﹣+CO2=HCO3﹣+H2O、Ba2++CO32﹣=BaCO3↓,以此解答该题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,加入1.0mol A和2.2mol B进行如下反应:A(g)+2B(g)C(g)+D(g),在800℃时,D的物质的量n(D)和时间t的关系如图. 
(1)800℃时,0~5min内,以B表示的平均反应速率为 .
(2)利用图中数据计算在800℃时的平衡常数的数值为 .
(3)若700℃,反应达平衡时,A的浓度为0.55mol/L,则该反应为反应(填“吸热”或“放热”).
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06molL﹣1 , c(B)=0.50molL﹣1 , c(C)=0.20molL﹣1 , c(D)=0.018molL﹣1 , 则此时该反应(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对牙膏中摩擦剂成分及其含量进行探究.查资料得知:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成.
Ⅰ.取适量牙膏样品,加水充分搅拌、过滤.
(1)往滤渣中加入过量NaOH溶液,过滤.
氢氧化铝与NaOH溶液反应的离子方程式是 .
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸.
观察到的现象是 .
(3)Ⅱ.利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数. 
依据实验过程回答问题:
实验过程中需持续缓缓通入空气.其作用除了可搅拌B、C中的反应物外,还有: .
(4)装置D的作用是 .
(5)下列各项措施中,不能提高测定准确度的是(填标号).
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A﹣B之间增添盛有浓硫酸的洗气装置
d.在B﹣C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取 8.00g样品三份,进行三次测定,测得BaCO3平均质量为 3.94g.则样品中碳酸钙的质量分数为 .
(7)Ⅲ.56Ba与Mg在同一主族,Ba在周期表的位置是 , MgO的碱性比BaO
(填“强”或“弱”),Mg(OH)2的溶解度比Ba(OH)2的溶解度(填“大”或“小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷和红磷均能在空气中燃烧,且燃烧产物相同,但二者的燃烧热不同,通过实验可测得这两个反应的反应热. ① ![]() P4(s,白磷)+
P4(s,白磷)+ ![]() O2(g)═
O2(g)═ ![]() P4O10(s)△H1=﹣745.8kJmol﹣1
P4O10(s)△H1=﹣745.8kJmol﹣1
②4P(s,红橉)+5O2(g)═P4O10(s)△H2=﹣2954kJmol﹣1
(1)白磷和红磷的关系是 . a.同一种物质 b.同位素 c.同分异构体 D.同素异形体
(2)红磷的燃烧热是kJmol﹣1 , 白磷的燃烧热比红磷的燃烧热(填“大”或“小”).
(3)白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=﹣29.2kJmol﹣1 . 在相同的条件下,能量较低的是(填“白磷”或“红磷”),白磷的稳定性比红磷(填“高”或“低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电池的叙述正确的是
A. 华为 Mate 系列手机采用的超大容量高密度电池是一种一次电池
B. 原电池中的电极一定要由两种不同的金属组成
C. 原电池中发生氧化反应的电极是负极
D. 太阳能电池主要材料为二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料﹣﹣光导纤维,C与烧碱反应生成含A元素的化合物D.
(1)与A同族但相对原子质量比A小的元素B的原子结构示意图为 .
(2)C与氢氟酸反应的化学方程式是 .
(3)将C与纯碱混合高温熔融时反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,生成了含A的化合物F.
①生成D和F的化学方程式分别为、 .
②要将纯碱高温熔化,下列坩埚中可选用的是 .
A.普通玻璃坩埚B.石英玻璃坩埚C.氧化铝坩埚D.铁坩埚.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是( )
A. 天然气燃烧B. 酸碱中和
C. 单质碘升华D. Ba(OH)28H2O晶体与NH4Cl晶体混合并搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42﹣ .
Ⅰ某校研究性学习小组设计如图流程以回收铜和硫酸亚铁.请回答: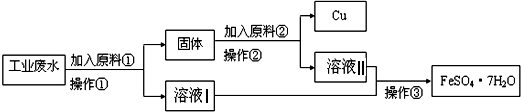
(1)反应①的离子方程式为 .
(2)操作①中用到的玻璃仪器是(填序号).
a.烧杯 b.漏斗 c.玻璃棒 d.酒精灯
(3)固体成份是(填名称).
(4)原料②的名称为 .
Ⅱ回收的铜可用于制备胆矾(CuSO45H2O).,可将铜和一定浓度稀硫酸混合后并在加热的情况下通入氧气,发生如下反应:2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
2CuSO4+2H2O.制得硫酸铜溶液后经过蒸发、浓缩,冷却结晶,过滤可得胆矾.
①请分析2Cu+2H2SO4+O2 ![]() 2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
2CuSO4+2H2O反应中,氧化剂是 , 还原剂是(填化学式).
②用双线桥标出上述反应的电子得失 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com