
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
(1)�����ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㣮��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�
2NO��2COΪ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������

��ش���������(���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ��)��
��ǰ2 s�ڵ�ƽ����Ӧ����v(N2)��________��
�ڼ������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ���________��
A��ѡ�ø���Ч�Ĵ���
B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶�
D�������������
(2)��֪��2SO2(g)��O2(g)![]() 2SO3(g)����H����196.6 kJ��mol��1
2SO3(g)����H����196.6 kJ��mol��1
2NO(g)��O2(g)![]() 2NO2(g)����H����113.0 kJ��mol��1
2NO2(g)����H����113.0 kJ��mol��1
��ӦNO2(g)��SO2(g)![]() SO3(g)��NO(g)�Ħ�H��________kJ��mol��1��
SO3(g)��NO(g)�Ħ�H��________kJ��mol��1��
һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬����________��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ���
d��ÿ����1 mol��SO3��ͬʱ����1 mol��NO2
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K��________��
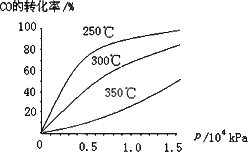
(3)CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)��2H2(g)![]() CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H________0(���������)��
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ����ͼ��ʾ���÷�Ӧ��H________0(���������)��
 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
��2011?ɽ�����о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮| ���� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
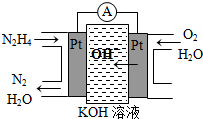 ���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������
���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г������������Իش���������| ���� | CO | H2 | CH3OH |
| Ũ�ȣ�mol?L-1�� | 0.9 | 1.0 | 0.6 |
| 2 |
| 3 |
| 2 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| ���� |
| 8 |
| 3 |
| 8 |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮| ���� | ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com