



科目:高中化学 来源: 题型:
 (2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:
(2012?石家庄一模)常温下,A为无色无味液体,B为淡黄色粉末,D、E、G、W为气体,且G的相对分子质量比D大16,各物质间的转化关系如图所示:| 9 |
| 4 |
| 物质 | A | D | G | W |
| 浓度/(mol?L-1) | 0.45 | 0.45 | 0.55 | 0.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.35mol?L-1 | B、Y2为0.45mol?L-1 | C、X2为0.2 mol?L-1 | D、Z为0.4mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Z为0.3mol.L-1, | B、X2为0.2mol.L-1, | C、Y2为0.3mol.L-1, | D、Z为0.4mol.L-1, |
查看答案和解析>>
科目:高中化学 来源: 题型:
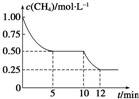 在密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断不正确的是( )
在密闭容器中进行反应CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,测得c(CH4)随反应时间(t)的变化如图所示.下列判断不正确的是( )| A、10min时,改变的外界条件可能是升高温度 | B、0~10min内,v(H2)=0.15mol?L-1?min-1 | C、恒温下,缩小容器体积,一段时间内v逆>v正 | D、12min时,反应达平衡的本质原因是气体总质量不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com