
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,写出其热反应方程式:_____________________________________。
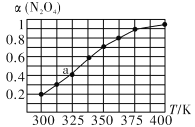
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①由图推测该反应ΔH_______0(填“>”或“<”),理由为__________________________。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp =____________。(保留一位小数,并带单位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③在一定条件下,该反应N2O4、NO2两者的消耗速率与自身压强间存在关系:v消耗(N2O4)=k1· P(N2O4),v消耗(NO2)=k2·P2(NO2),其中k1、k2是与反应温度有关的速率常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=________________。
【答案】 2N2H4(l)+N2O4(g)==3N2(g)+4H2O(g) ΔH= -1077 kJ/mol > 升温, N2O4的转化率增大,表明平衡向正反应方向移动,而升温平衡是向吸热反应方向移动的,所以正反应为吸热反应,ΔH>0 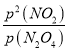 =
=![]() p0(N2O4)=
p0(N2O4)= ![]() ×108kPa=115.2kPa
×108kPa=115.2kPa ![]() k2Kp
k2Kp
【解析】(1)N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,则热反应方程式为2N2H4(l)+N2O4(g)==3N2(g)+4H2O(g) ΔH= -1077 kJ/mol,故答案为:2N2H4(l)+N2O4(g)==3N2(g)+4H2O(g) ΔH= -1077 kJ/mol;
(2)①根据图知,升高温度转化率增大,升高温度平衡向吸热方向移动,则正反应是吸热反应,故答案为:>;温度升高,α(N2O4)增加,说明平衡右移,该反应为吸热反应,△H>0;
②四氧化二氮的转化率是0.4,设原来四氧化二的物质的量为xmol,转化的物质的量为0.8xmol,则混合气体的物质的量=(x-0.4x+0.8x)mol=1.4xmol,相同条件下,气体的压强之比等于其物质的量之比,所以反应后压强=![]() =151.2kPa,四氧化二氮的分压=151.2kPa×
=151.2kPa,四氧化二氮的分压=151.2kPa×![]() =64.8kPa,二氧化氮的分压=151.2kPa×
=64.8kPa,二氧化氮的分压=151.2kPa×![]() =86.4kPa,化学平衡常数K=
=86.4kPa,化学平衡常数K=![]() =
=![]() =115.2,故答案为:115.2;
=115.2,故答案为:115.2;
③化学平衡常数Kp=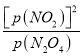 ,二者的反应速率之比等于其计量数之比,所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1p(N2O4)=2:1,化学平衡常数Kp=
,二者的反应速率之比等于其计量数之比,所以υ(NO2):υ(N2O4)=k2[p(NO2)]2:k1p(N2O4)=2:1,化学平衡常数Kp=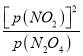 ,则k1=
,则k1=![]() k2·Kp,故答案为:
k2·Kp,故答案为: ![]() k2·Kp。
k2·Kp。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
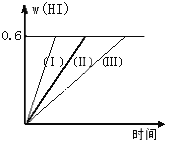
(1)达平衡时,I2(g)的物质的量浓度为____________________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是____________,则乙条件可能是_____________ 。(填入下列条件的序号)
①恒容条件下,升高温度;②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;⑤恒温恒容条件下,加入适当催化剂。
(3)若保持温度不变,在另一个相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属材料的说法中,不正确的是( )
A. 钢是用量最大、用途最广的合金
B. 合金只含金属元素
C. 铝制饮料罐应回收利用
D. 青铜是铜合金中的一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,重水( D2O)的离子积常数为1.6×10-15,若用定义pH一样规定pD= -lgc(D+),则在该温度下,下列叙述正确的是
A. 纯净的重水中,c(D+) ·c(OD-)>1.0×10-14
B. l L溶解有0.01 mol DCl的重水溶液,其pD=2
C. 1 L溶解有0. 01 mol NaOD的重水溶液,其pD=12
D. 纯净的重水中,pD=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有相同质子数和电子数的两种微粒之间的关系不正确的是:
A. 它们可能是同位素 B. 可能是不同的分子
C. 可能是不同的离子 D. 可能是一种分子和一种离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式,并回答相关问题:
(1)草酸使酸性高锰酸钾溶液褪色的离子方程式为____________________________________;紫色溶液的褪色速率先慢后快,然后又变慢,褪色速率加快的原因是__________________________________。
(2)0.1 mol/L硫代硫酸钠与0.1mol/L稀硫酸反应的离子方程式为_____________________________,实验现象为_______________________________。
(3)①H2O2在常温下分解比较慢,但在MnO2催化下可以剧烈分解,并且剧烈放热。写出反应的化学方程式:________________________________。
②实验室常用过氧化钡与稀硫酸反应制取H2O2,写出反应的化学方程式:_______________________。
③Na2O2与水的反应历程实际上是Na2O2先和水反应生成H2O2,然后H2O2再分解产生氧气。②和③的实验说明H2O2保存在酸性溶液中比在碱性溶液中_________(填“稳定”“不稳定”或“一样稳定”),说明_________(填离子符号)能够催化H2O2分解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+===Cu2++H2↑,则下列关于该装置的说法正确的是( )
A. 该装置可能是原电池,也可能是电解池
B. 该装置只能是原电池,且电解质溶液为HNO3溶液
C. 该装置只能是电解池,且金属铜为该电解池的阳极
D. 该装置只能是原电池,电解质溶液不可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
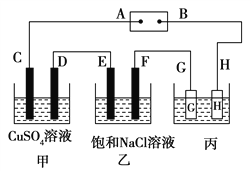
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com