

分析 ①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等;
②“白色污染”的生活垃圾--塑料属于可回收垃圾;
③A.混凝剂适用于除去废水中的悬浮物;
B.中和法适用于除去废水中的酸;
C.沉淀法适用于除去废水中的重金属离子.
解答 解:①空气质量报告的主要内容包括:空气污染指数、首要污染物(包括可吸入颗粒物、二氧化硫、二氧化氮等气体)、空气质量级别、空气质量状况等,
故选:B;
②“白色污染”的生活垃圾---塑料属于可回收垃圾,故选:a;
③A.废水中的悬浮物,常用混凝剂,故A不选;
B.中和法适用于除去废水中的酸,故B选;
C.沉淀法适用于除去废水中的重金属离子,故C不选;
故选:B.
点评 本题考查了生活中的化学,熟悉常见的环境污染与治理方法即可解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
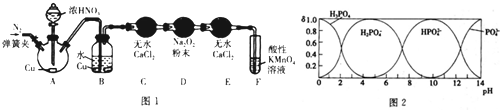
| 化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×108 | 4.9×10-10 | K1=4.3×10-7 K1=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
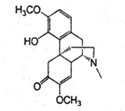
| A. | 每个青藤碱分子中含有2个手性碳原子 | |
| B. | 1mol最多能与1molBr2发生反应 | |
| C. | 1mol最多能与4molH2发生反应 | |
| D. | 青藤碱既能与盐酸反应又能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH均为11的下列溶液:①NaOH ②KHCO3③CH3COONa,其浓度大小:①>③>② | |
| D. | 常温下NaB溶液的pH=8,则c(Na+)-c(B-)=9.9×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液漏斗中盛放液体的总体积不得超过其容量的$\frac{2}{3}$ | |
| B. | 某学生用广泛pH试纸测得某溶液的pH为0 | |
| C. | 实验室制取乙酸乙酯用稀硫酸做催化剂效果会更好 | |
| D. | 焰色反应实验,所用铂丝先用盐酸洗涤并在酒精灯火焰上灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )
25℃时,将氨水与氯化铵溶液混合得到 c(NH3•H2O)+c(NH4+)=0.1mol•L-1的混合溶液.溶液中c(NH3•H2O)、c(NH4+)与pH的关系如图所示.下列有关离子浓度关系叙述一定正确的是( )| A. | W点表示溶液中:c(NH4+)+c(H+)=c(OH-) | |
| B. | pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3•H2O)<0.1 mol•L-1 | |
| C. | pH=9.5溶液中:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com