
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
下列有关说法中,不正确的是
A.“光化学烟雾”“硝酸型酸雨”的形成都与氮氧化合物有关
B.根据分散质微粒直径大小可以将分散系分为溶液、胶体和浊液
C.SiO2可用于制造光导纤维,其性质稳定,不溶于强酸、强碱
D.焰火的五彩缤纷是某些金属元素的性质的表现
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
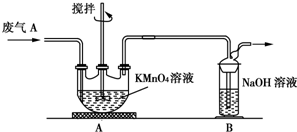
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 1.5mol•L-1的CaCl2溶液 | B. | 100mL 3mol•L-1的NH4Cl溶液 | ||
| C. | 75mL 3mol•L-1的KCl溶液 | D. | 50mL 2mol•L-1的FeCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,则原溶液中无NH4+ | |
| B. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| C. | 光照氯水有气泡冒出,该气体为Cl2 | |
| D. | 用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com