
| ||
| ||
| ||
| 0.1mol |
| 0.5L |


科目:高中化学 来源: 题型:
| A、c(HCO3-)=1×10-1mol/L的溶液中Na+、AlO2-、CH3COO-、K+ |
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+ |
| C、甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+ |
| D、能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.
二氧化碳、碳酸钠和碳酸氢钠都是碳的重要化合物,它们在生活生产中都有着广泛的应用.甲、乙、丙三组同学分别对二氧化碳、碳酸钠、碳酸氢钠的相关问题进行了以下探究,请你参与并完成对有关问题的解答.| 盐酸溶液体积/mL | 40.00 | 40.00 | 40.00 | 40.00 |
| 样品质量/g | 7.200 | 10.80 | 14.40 | 21.60 |
| CO2质量/g | 3.080 | 4.620 | 3.520 | 0.880 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化合物A的分子式为C3H6O2转化关系如图:
化合物A的分子式为C3H6O2转化关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
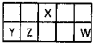 I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:| 温度/℃ | 400 | 500 | 600 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
| B、硫酸钠与氯化钡溶液混和:SO42-+Ba2+═BaSO4↓ |
| C、硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
| D、氧化铜与硫酸混和:Cu2++SO42-═CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含Pb2+、Cu2+、Hg2+的浓度均为0.010 mol?L-1的溶液中通人硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS |
| B、在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜 |
| C、在含Hg2+、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当c(S2-)=0.001 mol?L-1时三种金属离子都完全沉淀 |
| D、硫化钠是处理废水中含上述金属离子的沉淀剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com