
已知2SO2+O2 2SO3是一个正反应放热的可逆反应。如果反应在密闭容器中进行,则下列有关途述正确的是
2SO3是一个正反应放热的可逆反应。如果反应在密闭容器中进行,则下列有关途述正确的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.升高温度可加快逆反应速率但不能改变正反应速率
C.一定条件下,SO2可100%转化为SO3
D.任何条件下,反应达到平衡,SO2的浓度一定等于SO3的浓度
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
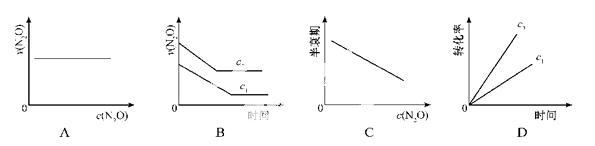
在一定条件下,N2O分解的部分实验数据如下:

下图能正确表示该反应有关物理量变化规律的是
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
查看答案和解析>>
科目:高中化学 来源: 题型:
关于反应热请回答如下问题:
(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为 。
(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,请写出热化学反应方程式:_________________________ 。
(3)已知反应CH3—CH3(g)―→CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C—H | C=C | C—C | H—H |
| 键能/kJ·mol-1 | 414.4 | 615.3 | 347.4 | 435.3 |
试计算该反应的反应热___________________________
(4)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既属于氧化还原反应同时又属于吸热反应的是
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸反应 D.H2与O2的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
完全燃烧2mol某有机物,可以收集到标准状况下89.6L的CO2和6mol的H2O,同时消耗6molO2,试推断该有机物的分子式是
A.C2H4 B.C2H4O C.C2H6 D.C2H6O
查看答案和解析>>
科目:高中化学 来源: 题型:
按下图电解NaCl的饱和溶液,写出该电解池中发生反应的总反应方程式:________。

将充分电解后所得溶液逐滴加入到酚酞试液中,观察到的现象是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com