
下表为元素周期表的一部分,请参照元素A-H在表中的位置,
| 族 周期 | IA |
| 0 | |||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
| 2 |
|
|
| B | C | D |
|
|
| 3 | E |
| F | G |
|
| H |
|
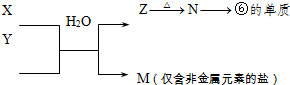
用化学用语回答下列问题:
(1)D、E、F的原子半径由大到小的顺序为_________________________。
(2)B、C、D的第一电离能由大到小的顺序为_________________________。
(3)A、D、E、H中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4) E、F的最高价氧化物的水化物相互反应的离子方程式 。
(5)在B所形成的化合物CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 ;
与CO分子互为等电子体的分子和离子分别为 和 ,根据等电子理
论推测CO分子的结构式可表示成 ,一个CO分子中有 个σ键, 个л键。
(6)根据VSEPR理论预测D和H所形成的HD4—离子的空间构型为______________型。
(7)由A、B、C、D、E元素组成的10电子粒子中,含配位键的有 、 ;
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||





查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一周期 | 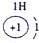 |
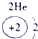 | ||||||
| 第二周期 | 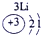 |
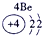 |
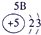 |
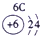 |
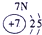 |
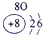 |
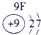 |
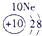 |
| 第三周期 | 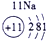 |
 |
 |
 |
 |
 | ||
 表示的是
表示的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com