
已知2SO2+O2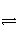
 2SO3为放热反应,对该反应的下列说法正确的是( )
2SO3为放热反应,对该反应的下列说法正确的是( )
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放热反应,故不必加热就可发生
科目:高中化学 来源: 题型:
新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
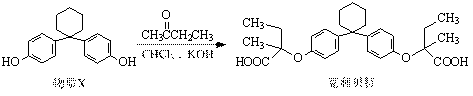
下列有关叙述正确的是
A.克利贝特的分子式为C28H34O6
B.物质X分子中所有碳原子可能位于同一平面内
C.用饱和NaHCO3溶液可以鉴别物质X和克利贝特
D.1 mol物质X最多可以与含2 molBr2的溴水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2被称为“空中死神”,其对环境的危害常表现为__________________。为了减少危害,人们进行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。
(1)工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于__________氧化物的性质。
(2)近年来,有人提出了一种利用电解饱和氯化钠溶液(2NaCl+2H2O===2NaOH+Cl2+H2)循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:
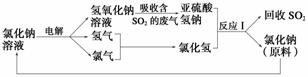
①此种方法中,可以循环利用的物质是_____________________________________。
②写出反应Ⅰ的离子方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国三峡工程所提供的清洁、廉价、强劲、可再生的水电,相当于每年燃烧3×106t原煤的火力发电厂产生的电能。因此,三峡工程有助于控制 ( )
A.温室效应和酸雨 B.赤潮 C.白色污染 D.破坏大气臭氧层
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物分子结构说法不正确的是( )
A.苯的邻位二溴代物只有一种能证明苯分子中不存在碳碳单、双键交替的排布
B.乙烯容易与溴水发生加成反应,且1 mol乙烯完全加成消耗1 mol溴单质能证明乙烯分子里含有一个碳碳双键
C.甲烷的一氯代物只有一种可证明甲烷为正四面体结构
D.1 mol乙醇与足量的钠反应生成0.5 mol氢气,可证明乙醇分子中只有一个羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是( )
A.正极反应式为:O2+2H2O+4e-===4OH-
B.工作一段时间后,电解液中KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2===2H2O
D.该电池工作时每消耗1 mol O2,有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
准确称取某种铁的氧化物2.88 g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4 g,则这种铁的氧化物为 ( )
A. Fe3O4 B.Fe2O3 C. FeO D.以上都不是
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
①铁能被磁铁吸引 ②在人体的血红蛋白中含有铁元素 ③镁在空气中可剧烈燃烧,并发出强光 ④铁能在氧气中剧烈燃烧,生成黑色的Fe3O4 ⑤在空气中加热铜可生成黑色的CuO
A.①②④⑤ B.②③④⑤ C.①③④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天
然气(主要成分为CH4)与水进行高温重整制备合成气。
⑴ 已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和
-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。用1 m3(标准状况)的
甲烷与水蒸气在高温下反应制取合成气所需的热量为 (保留整数)。
⑵ 在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得
CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
|

 | 0 | 1 | 2 | 3 | 4 | ||||||
| CH4 | 0.2mol·L-1 | 0.13 mol·L-1 | 0.1 mol·L-1 | 0.1 mol·L-1 | 0.09 mol·L-1 | ||||||
| H2 | 0 mol·L-1 | 0.2 mol·L-1 | 0.3 mol·L-1 | 0.3 mol·L-1 | 0.33 mol·L-1 |
①计算该反应第一次达平衡时的平衡常数K 。
②3min时改变的反应条件是 (只填一种条件的改变即可)。
⑶ 已知温度、压强、投料比X对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1 X2(填“=”、“>”或“<”下同)。
②图2中两条曲线所示的压强比的关系:P1 P2。
⑷ 以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为 。
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下
的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com