
| X | Y | |
| Z | W |
| A. | 最高正化合价:Z>X=W>Y | |
| B. | 原子半径:Y>X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
分析 W是组成信息高速公路骨架的元素之一,应为Si元素,根据X、Y、Z、W在元素周期表中的位置可知X为C元素,Y为N元素,Z为Al元素,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:W是组成信息高速公路骨架的元素之一,应为Si元素,根据X、Y、Z、W在元素周期表中的位置可知X为C元素,Y为N元素,Z为Al元素,
A.Z为Al,最高化合价为+3价,而Y为N,最高化合价为+5价,故A错误;
B.同周期元素从左到右原子半径逐渐减小,则X>Y、Z>W,故B错误;
C.非金属性N>C>Si>Al,元素的非金属性越强,对应的最高价氧化物对应水化物的酸性越强,故C错误;
D.最高价含氧酸的钠盐分别为Na2CO3、NaNO3、NaAlO2、Na2SiO3,由于亚硫酸酸性比碳酸、硅酸强,则二氧化硫可与Na2CO3、Na2SiO3溶液反应生成二氧化碳、硅酸,NaAlO2溶液与二氧化硫反应生成氢氧化铝沉淀,二氧化硫水溶液呈酸性,而硝酸根离子在酸性条件下具有强氧化性,则NaNO3可与二氧化硫在溶液中发生氧化还原反应,故D正确.
故选D.
点评 本题考查位置、结构、性质的关系及应用,把握元素在周期表中的位置及元素周期律为解答的关键,注意利用实例分析,侧重分析能力和归纳能力的考查,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+ = Cu2++H2 ↑
↑
B.向CH3COOH溶液中加入CaCO3:2 CH3COOH+CaCO3 = 2 CH3COO-+Ca2++H2O+CO2↑
C.稀硫酸与Ba(OH)2溶液混合:H++ SO +OH-+ Ba2+ = BaSO4↓+H2O
+OH-+ Ba2+ = BaSO4↓+H2O
D.NaOH溶液与KHCO3溶液混合:OH- + HCO3- = H2O +CO2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证乙烯与溴发生加成反应 | 乙烯通入溴水中,测定反应前后溶液pH |
| B | 检验氯化铁溶液中是否含FeCl2 | 向氯化铁溶液中滴加铁氰化钾溶液 |
| C | 检验乙酸中是否混有乙醇 | 取样液于试管,加入一绿豆颗粒大的钠粒 |
| D | 验证Ksp(AgI)<Ksp(AgCl) | 向含等物质的量NaCl、KI的混合液中滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
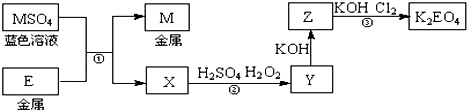
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
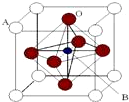 某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).
某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应).| 碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 900 | 1172 | 1360 |
| 阳离子半径/pm | 99 | 112 | 135 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 | |
| B. | 工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 | |
| C. | 由于铝的导电性比铜、银都强,所以常用来制造电线、电缆 | |
| D. | NH3能氧化氮氧化物,可用于汽车尾气净化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl-、HCO3- | B. | Na+、NO3-、SO42-、I- | ||
| C. | Na+、Mg2+、Cl-、SO42- | D. | Fe3+、K+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com