
| A. | 等浓度等体积H2A与NaOH的混合溶液呈碱性 | |
| B. | H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B | |
| C. | NaHB溶液一定显酸性 | |
| D. | 等浓度等体积的NaHA与Na2B混合,混合溶液中存在这样的关系:c(A2-)>c(B2-)>c(HA-)>c(HB-) |
分析 A.等浓度等体积H2A与NaOH的混合得到NaHA溶液,溶液HA-水解程度和电离程度大小不知不能判断溶液酸碱性;
B.结合酸性强弱顺序H2A>H2B>HA->HB-分析判断反应是否进行;
C.NaHB溶液中HB-离子的电离和水解程度不知不能确定溶液酸碱性;
D.等浓度等体积NaHA 与Na2B 的混合溶液中c(A2-)<c(B2-);
解答 解:A.等浓度等体积H2A与NaOH的混合,得到NaHA溶液,溶液HA-水解程度和电离程度大小不知溶液不一定呈碱性,故A错误;
B.酸性强弱顺序H2A>H2B>HA->HB-,H2A与少量B2-反应的离子方程式为2H2A+B2-=2HA-+H2B,故B正确;
C.NaHB溶液中HB-离子电离程和水解程度大小不知不能确定溶液酸碱性,故C错误;
D.酸性强弱顺序H2A>H2B>HA->HB-,等浓度等体积NaHA 与Na2B 的混合溶液中c(A2-)<c(B2-),故D错误;
故选B.
点评 本题考查了弱电解质电离平衡的分析应用,主要是盐类水解和对应酸的酸性强弱应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40gNaOH固体溶解于1L水中 | |
| B. | 将22.4L氯化氢气体溶于水配成1L溶液 | |
| C. | 将1L 10 mol/L的浓盐酸与9L水混合 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦⑩ | B. | ①④⑧⑩ | C. | ③⑥⑦⑨ | D. | ③⑤⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲中负极反应式为Ag++e-═Ag | |
| B. | 丙中H+向碳棒方向移动 | |
| C. | 乙中阳极反应式为2H++2e-═H2↑ | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
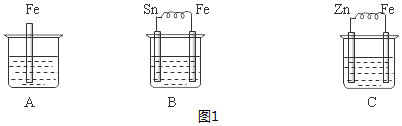
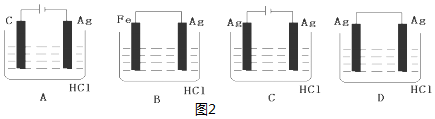
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com