
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.分析 (Ⅰ)(1)由K可知反应物及生成物;
(2)结合平衡的特征“等、定”及衍生的物理量分析平衡状态;
(Ⅱ)(1)结合v=$\frac{△c}{△t}$计算;
(2)Fe为纯固体,改变用量平衡不移动;而继续通入1mol H2O(g),相当于加压,平衡向气体体积缩小的方向移动,但K不变,结合K计算;
(3)t1时改变了某种条件,逆反应速率增大,结合影响反应速率的因素来解答.
解答 解:(Ⅰ)(1)由K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$可知,反应物为C、H2O,生成物为CO、H2,该反应为C(s)+H2O(g)?CO(g)+H2(g),
故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)A.混合气体的质量、物质的量均为变量,则容器中气体的平均相对分子质量不随时间而变化,反应达到平衡,故A选;
B.υ正(H2O)=υ逆(H2),不同物质的正逆反应速率之比等于化学计量数之比,反应达到平衡状态,故B选;
C.体积不变,混合气体的质量为变量,则容器中气体的密度不随时间而变化,反应达到平衡,故C选;
D.反应为总物质的量不变的反应,则容器中总的物质的量不随时间而变化,不能判定平衡,故D不选;
E.消耗n mol H2的同时消耗n mol CO,只体现逆反应速率,不能判定平衡,故E不选;
故答案为:ABC;
(Ⅱ)(1)t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol,则v=$\frac{△c}{△t}$=$\frac{\frac{0.35mol-0.2mol}{5L}}{{t}_{1}-{t}_{2}}$=$\frac{0.03}{{t}_{1}-{t}_{2}}$mol/(L.s),
故答案为:$\frac{0.03}{{t}_{1}-{t}_{2}}$mol/(L.s);
(2)Fe为纯固体,改变用量平衡不移动,在加入Fe后,Fe是固体,平衡不移动;3Fe+4H2O=Fe3O4+4H2,K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$,再加入1molH2O(g),浓度增大一倍,再次达到平衡,化学平衡常数不变,则H2的物质的量为原来的2倍,故答案为:不;0.7;
(3)t1时改变了某种条件,逆反应速率增大,则改变条件为加催化剂或升高温度或增大氢气的浓度等,故答案为:加催化剂.
点评 本题考查化学平衡常数及应用,为高频考点,把握化学反应速率及平衡的影响因素、化学平衡常数的意义及计算等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向Ba(NO3)2溶液中通入过量SO2:3Ba2++3SO2+2NO3-+2H2O═2NO↑+3BaSO4↓+4H+ | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其合成路线如图所示:
,其合成路线如图所示:
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/LNaHSO4与0.5mol/LBa(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2mol/LFe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20mL0.5mol/LFeBr2(aq)中通入224mLCl2(标况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30mL0.5mol/LNaOH(aq)中通入224mLCO2(标况):3OH-+2CO2═CO32-+HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
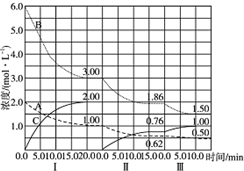 反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:
反应:aA(g)+bB(g)$\stackrel{催化剂}{?}$cC(g)(△H<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑦ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com