
| A. | 石英 | B. | 食盐 | C. | 干冰 | D. | 碘 |
科目:高中化学 来源: 题型:选择题
| A. | +244.1 kJ•mol-1 | B. | -488.3 kJ•mol-1 | C. | -996.6 kJ•mol-1 | D. | +996.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H1 | B. | S(s)+3/2O2(g)=SO3(s)△H2 | ||
| C. | CH4(g)+2O2(g)=2H2O(l)+CO(g)△H3 | D. | 2CO(g)+O2(g)=CO2(g)△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
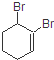 的系统命名的名称是( )
的系统命名的名称是( )| A. | 1,2-二溴-2-环己烯 | B. | 1,2-二溴-1-环己烯 | ||
| C. | 1,6-二溴-1-环己烯 | D. | 2,3-二溴-1-环己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SiO3>H2CO3>H3PO4 | B. | 稳定性:PH3<H2S<HCl<HF | ||
| C. | 非金属性:Cl>S>P>Si | D. | 离子半径:Cl->F->Na+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱 | B. | 一元强碱 | C. | 多元强碱 | D. | 任何强碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com