
某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、SO42—和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如下:
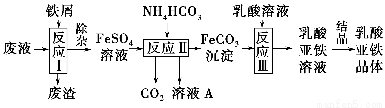
(1)反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+??2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K=________。
(2)反应Ⅱ需控制反应温度低于35 ℃,其目的是________________,该反应的化学方程式是________________。检验溶液A中是否含Fe2+的实验操作方法是_________________________________________________________。
(3)已知:FeCO3(s)??Fe2+(aq)+CO32—(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因______________________________________________。
(4)结晶过程必须控制在一定的真空度条件下进行,原因是_______________________________________________________。
(1)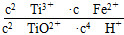
(2)防止NH4HCO3分解(或减少Fe2+的水解)
FeSO4+2NH4HCO3=FeCO3↓+H2O+CO2↑+(NH4)2SO4 取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水或H2O2,溶液呈血红色,证明有Fe2+,反之,不含有Fe2+
(3)CO32—与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
(4)有利于水的蒸发、防止Fe2+被氧化
【解析】 (1)由反应关系可写出反应2TiO2++Fe+4H+ 2Ti3++Fe2++2H2O的平衡常数表达式为
2Ti3++Fe2++2H2O的平衡常数表达式为 。(2)反应Ⅱ需要控制反应温度低于35 ℃的目的是防止碳酸氢铵分解,减少Fe2+的水解,由反应物和主要产物可写出反应Ⅱ的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O;检验溶液中是否有Fe2+可以先加硫氰化物溶液,然后加合适的氧化剂,看溶液是否变为血红色。(3)碳酸亚铁溶液中存在沉淀溶解平衡,其中的CO32—和乳酸反应,使碳酸亚铁的溶解平衡向溶解方向移动,生成乳酸亚铁。(4)由于Fe2+易被氧化,真空可以防止Fe2+被氧化,同时有利于水分蒸发有利于晶体结晶。
。(2)反应Ⅱ需要控制反应温度低于35 ℃的目的是防止碳酸氢铵分解,减少Fe2+的水解,由反应物和主要产物可写出反应Ⅱ的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O;检验溶液中是否有Fe2+可以先加硫氰化物溶液,然后加合适的氧化剂,看溶液是否变为血红色。(3)碳酸亚铁溶液中存在沉淀溶解平衡,其中的CO32—和乳酸反应,使碳酸亚铁的溶解平衡向溶解方向移动,生成乳酸亚铁。(4)由于Fe2+易被氧化,真空可以防止Fe2+被氧化,同时有利于水分蒸发有利于晶体结晶。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷(解析版) 题型:选择题
有下列三个反应方程式:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,下列说法正确的是( )。
A.①②③中氧化产物分别是FeCl2、Fe3+、Cl2
B.根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+
C.在反应③中生成1 mol Cl2时,有2 mol HCl被氧化
D.根据反应①②一定可以推理得到Cl2+FeBr2=FeCl2+Br2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第13讲实验方案设计与评价练习卷(解析版) 题型:实验题
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】 ①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:

请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:___________________________________。
(2)E装置的作用是_______________________________________________。
如果拆去B装置,可能的后果是______________________________________
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:__________________________________________________________;
实验室保存三氯化硼的注意事项是_________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第11讲有机化学基础练习卷(解析版) 题型:填空题
化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下:

(1)化合物D中官能团的名称为________、________和酯键。
(2)A→B的反应类型是____________。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式:________________。
①分子中含有两个苯环;②分子中有3种不同化学环境的氢;③不含—O—O—。
(4)实现D→E的转化中,化合物X的分子式为C19H15NFBr,写出其结构简式:________________。
(5)已知:化合物E在CF3COOH催化作用下先转化为 ,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
(6)上述合成路线中,步骤③的产物除D外还生成 ,该反应原理在有机合成中具有广泛应用。试写出以
,该反应原理在有机合成中具有广泛应用。试写出以 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第11讲有机化学基础练习卷(解析版) 题型:选择题
NM?3是处于临床试验阶段的小分子抗癌药物,分子结构如右图。下列说法正确的是( )。

A.该有机物的分子式为C12H12O6
B.1 mol该有机物最多可以和3 mol NaOH反应
C.该有机物容易发生加成、取代、消去等反应
D.该有机物分子中只含有1个手性碳原子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第10讲金属元素及其化合物练习卷(解析版) 题型:选择题
下列是部分矿物资源的利用及产品流程,有关说法不正确的是( )。

A.粗铜电解精炼时,粗铜做阳极
B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C.黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用做冶铁的原料
D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练专题12物质结构与性质(选修)练习卷(解析版) 题型:选择题
有关晶体的结构如图所示,下列说法中不正确的是( )。

A.在NaCl晶体(图甲)中,距Na+最近的Cl-形成正八面体
B.该气态团簇分子(图乙)的分子式为EF或FE
C.在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D.在碘晶体(图丁)中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题9非金属元素及其化合物练习卷(解析版) 题型:选择题
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )。
A.反应后溶液中c(NO3-)=0.85 mol·L-1
B.反应后的溶液最多还能溶解1.82 g Fe
C.反应前HNO3溶液的浓度为1.0 mol·L-1
D.1.12 L气体是NO、NO2的混合气体
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题4物质结构元素周期律练习卷(解析版) 题型:选择题
下列排列顺序正确的是( )。
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④失电子能力:Cs>Na
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com