
| 配料表 | 精制海盐、碘酸钾 |
| 含碘量 | 20~40mg/kg |
| 卫生许可证号 | ××卫碘字(1999)第001号 |
| 分装日期 | 见封底 |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹调时,待食品熟后加入碘盐 |
分析 食盐中的碘是以碘酸钾形式存在,计算含碘量是以碘元素进行计算,人体缺碘,易导致甲状腺疾病,根据化合价代数和为0判断元素的化合价,由题中信息可知,碘酸钾易分解.
解答 解:(1)人体缺碘,易导致甲状腺疾病,碘是人体内合成甲状腺激素的主要原料,故答案为:甲状腺;
(2)食盐中的碘是以碘酸钾形式存在,计算含碘量是以碘元素进行计算,碘盐中不存在碘原子和分子,在KIO3中,K的化合价为+1价,O的化合价为-2价,根据化合价代数和为0可知I的化合价为+5价,故答案为:元素;+5;
(3)烹调时,待食品熟后加入碘盐,说明碘酸钾不稳定,在加热时易分解,故答案为:分解.
点评 本题考查碘盐知识,题目难度不大,本题注意把握题给信息,并在学习中注意相关基础知识的积累.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+CO2↑+H2O | B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O | ||
| C. | Fe2O3+6HCl═2FeCl3+3H2O | D. | NH4NO3 $\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,写出它的一种用途做溶剂、灭火剂等.
,写出它的一种用途做溶剂、灭火剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
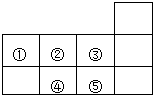
| A. | 元素①位于第二周期第ⅣA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 元素的最高正化合价:③=⑤ | D. | 最高价氧化物对应水化物酸性:⑤>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA | |
| B. | 3.4g NH3中含原子总数目为0.6NA | |
| C. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| D. | 23gNO2和N2O4的混合气体中含有原子总数1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| B. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- | |
| C. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| D. | 用四氯化碳萃取某溶液时,分层且下层显紫红色,可能存在碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com