
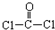 ,每个COCl2分子内含有
,每个COCl2分子内含有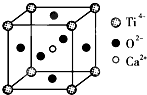


科目:高中化学 来源: 题型:
| A、乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 |
| B、苯和浓硝酸、浓硫酸混合物在100-110℃才能生成二硝基苯,而甲苯在100℃时即可生成三硝基甲苯,说明甲基对苯环产生了影响 |
| C、甲苯、苯乙烯、萘、硝基苯均属于芳香烃,其工业上主要来源为石油和煤 |
| D、除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
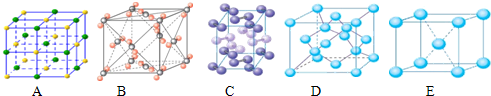
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
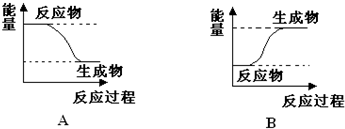
查看答案和解析>>
科目:高中化学 来源: 题型:
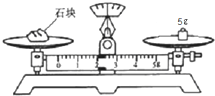 实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
实验室配制欲配制480mL4.0mol?L-1的NaOH溶液.根据配置溶液的具体过程回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com