
| A、6mol/L |
| B、3mol/L |
| C、2mol/L |
| D、1mol/L |
| n |
| V |
| 4.4mol |
| 2L |
| 3.6mol |
| 2L |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
 利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )
利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )| A、①②⑥ | B、②④ |
| C、①②③⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
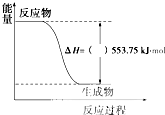 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
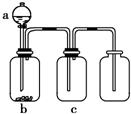 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀盐酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 800℃时,在2L密闭容器中发生2NO(g)+O2(g)?2NO2(g),测得n(NO)随时间的变化如下表:
800℃时,在2L密闭容器中发生2NO(g)+O2(g)?2NO2(g),测得n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com