
常温下,下列各组离子在指定溶液中一定能 大量共
大量共 存的是 ( )
存的是 ( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO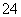 、CO
、CO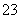
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO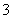 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH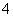 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO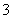
科目:高中化学 来源: 题型:
用质量分数为36.5 % 的浓盐酸(密度为1.2 g·cm-3)配制成250 mL 1.2 mol/L的稀盐酸。
(1)经过计算需要_______mL浓盐酸。
(2)在量取浓盐酸后,进行了如下操作:
① 等稀释的盐酸冷却到室温后,将溶液沿玻璃棒小心地注入到250 mL的容量瓶中。
② 往容量瓶中缓慢地加入蒸馏水至液面接近刻度线1 cm~2 cm处时,改用胶头滴管加蒸馏水,使溶液的凹液面正好与容量瓶的刻度线相切。
③ 在盛浓盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗液全部注入容量瓶中。
上述操作中,正确的顺序是______________(填编号)。
(3)配制完后,将容量瓶中的稀盐酸转移到指定的试剂瓶中存放,盖好塞子并贴上标签。
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、C O32-
O32-
B.c(H+)=1× 10-13mol/L的溶液中:Mg2+、Cu2+、SO
10-13mol/L的溶液中:Mg2+、Cu2+、SO 42-、NO3-
42-、NO3-
C.0.1mol/LNH4H CO3溶液中:K+、Na+、NO3-、Cl-
CO3溶液中:K+、Na+、NO3-、Cl-
D.0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.在100 mL浓度为1 mol·L-1的 Fe(NO3)3的溶液中通入足量SO2
2Fe3++SO2+2H2O=2Fe2++SO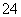 +4H+
+4H+
B.在100 mL浓度为2 mol·L-1的FeI2的溶液中通入标准状况下5.6 L的Cl2
4Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水
2HCO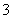 +Ca2++2OH-=CaC
+Ca2++2OH-=CaC O3↓+2H2O+CO
O3↓+2H2O+CO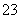
D.向明矾溶液中加入过量的氢氧化钡溶液
Al3++2SO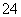 +2Ba2++4OH-=2BaSO4↓+AlO
+2Ba2++4OH-=2BaSO4↓+AlO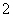 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应对应的离子方程式书写正确的是 ( )。
A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO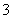
B.氢氧化钡溶液与硫酸氢钠溶液反应后溶液恰好为中性:
Ba2++H++SO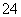 +OH-=BaSO4↓+H2O
+OH-=BaSO4↓+H2O
C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
D.在强碱性溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4,
4OH-+3ClO-+2Fe(OH)3=2FeO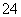 +3Cl-+5H2O
+3Cl-+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则
A.被氧化的砒霜为1.98mg
B.分解产生的氢气为0.672ml
C.和砒霜反应的锌为3.90mg
D.转移的电子总数为6×10—5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,11.2 L的H2O中含有1.5nA个原子
B.0.1 mol·L-1 的(NH4)2SO4溶液中,所含NH4+数小于0.2nA
C.常温常压下,16 g的O2和O3混合气体中,含有8nA个电子
D.质量相同的N2和CO中,含有2nA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌[来源:全,品…中&高*考+网] | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。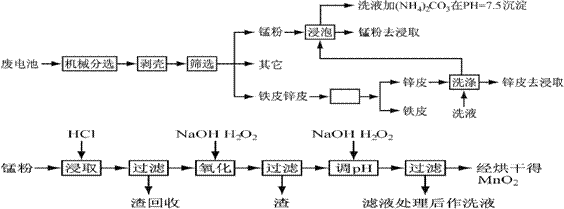
1、市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
;
6、硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com