
| 滴定序号 | 待测液体积 (mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
分析 (1)根据操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作选取实验仪器;
(2)①酸性溶液应用酸式滴定管盛放;
②滴定时眼睛注视锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)先分析数据的有效性,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量浓度,再计算烧碱样品的纯度;
(4)①指示剂局部的颜色有变化就停止滴定,反应没有结束,消耗的标准液体积偏小;
②滴定前仰视,导致读数偏大;滴定后俯视,导致读数偏小,导致标准液体积偏小.
解答 解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到1000ml容量瓶 容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是天平、药匙、烧杯、量筒、玻璃棒、100ml容量瓶、胶头滴管;
故答案为:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)①盛装0.1000mol•L-1盐酸标准液应该使用酸式滴定管;
故答案为:酸式;
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化,以判定滴定终点;
滴定时,当溶液颜色由红色变为无色,且半分钟内不变色,可说明达到滴定终点;
故答案为:锥形瓶内溶液颜色的变化;由红色变为无色,且半分钟内不变色;
(3)三次消耗盐酸体积分别为:20.70mL-0.50mL=20.20mL、26.00mL-6.00mL=20.00mL,两消耗盐酸的平均体积为:20.10mL,
NaOH~HCl
1 1
n(NaOH) 0.2mol•L-1×0.0201L
n(NaOH)=0.00402mol,故c(NaOH)=$\frac{0.00402mol}{0.02L}$=0.201mol/L,即20.00mL待测溶液含有m(烧碱)=n•M=0.00402mol×40g/mol=0.1608g,
所以100mL待测溶液含有m(烧碱)=0.1608g×$\frac{100}{20}$=0.804g,
烧碱的纯度ω(烧碱)=$\frac{0.804g}{0.85g}$×100%=94.6%,
故答案为:0.201mol/L;94.6%;
(4)①指示剂局部的颜色有变化就停止滴定,反应还没有结束,导致消耗的标准液体积偏小,测定结果偏低,
故答案为:偏低;
②滴定前仰视,导致标准液的体积读数偏大;滴定后俯视,导致标准液的体积的读数偏小,最终导致标标准液体积偏小,测定结果偏低;
故答案为:偏低.
点评 本题考查了滴定操作,操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
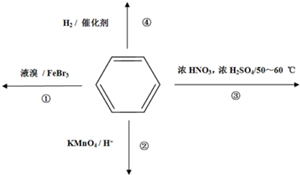
| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰为淡蓝色 | |
| C. | 反应③为取代反应,有机产物是一种烃的衍生物 | |
| D. | 反应④中1 mol苯最多与6 mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
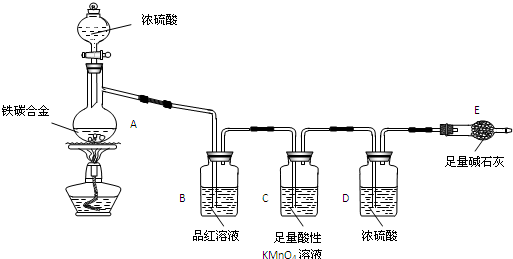
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
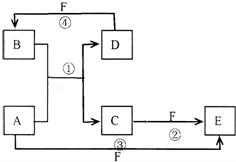 已知A、B、C、D、E、F六种物质的转化关系如图所示 (反应条件和部分产物未标出)
已知A、B、C、D、E、F六种物质的转化关系如图所示 (反应条件和部分产物未标出) ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2H2O═CH4+2O2 | B. | NaOH+HCl═NaCl+H2O | ||
| C. | 4Al+3O2+6H2O═4Al(OH)3 | D. | Cu+2HCl═CuCl2+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com