
A(盐)和B(酸)反应,可放出有气味的气体C,C跟KOH反应又得到A(盐),C氧化的最终产物为W气,W气溶于水又得到B(酸),则A(盐)和B(酸)是
A.K2S和稀H2SO4 B.K2SO3和盐酸
C.K2S和盐酸 D.K2S和稀HNO3
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:阅读理解
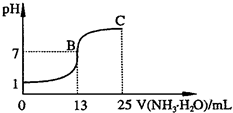 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下:
已知加热X与足理的NaOH水溶液反应时,得到A、B、C三种有机物,其中C中含
碳原子最多。室温下A经盐酸酸化可得到苹果酸E,E的结构简式为:
请回答:
(1) B中含有的官能团为 。(填名称)
(2)1molX与足量的NaOH水溶液充分反应,消耗NaOH的物质的量为 。
(3)C经酸化可得到有机物G,G不能发生的反应类型有 (填序号)。
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(4)1 molC酸化后与足量浓溴水充分反应需 mol Br2 。
(5) E在浓H2SO4作用下可生成六元环状化合物,其化学方程式为 。
(6)E的两种同分异构体F、G有如下特点:1molF或G可以和3molNa发生反应,放出标准状况下33.6LH2,1molF或G可以和足量NaHCO3溶液反应,生成1molCO2,1molF或G还可以发生银镜反应,生成2molAg。则F和G的结构简式分别是 、 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省温州市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
实验室制备肉桂酸的化学方程式为:

副反应:
药品物理常数

主要实验装置和步骤如下:

(I) 合成:
向装置1的三颈烧瓶中先后加入3g新熔融并研细的无水醋酸钠、3mL新蒸馏过的苯甲醛和 5.5mL乙酸酐,振荡使之混合均匀。在150~170℃加热回流40min,反应过程中体系的颜色会逐 渐加深,并伴有棕红色树脂物出现。
(II)分离与提纯:
①向反应液中加30mL沸水,加固体碳酸钠至反应混合物呈弱碱性。
②按装置2进行水蒸气蒸馏,在冷凝管中出现有机物和水的混合物,直到馏出液无油珠。
③剩余反应液体中加入少许活性炭,加热煮沸,趁热过滤,得无色透明液体。
④滤液用浓盐酸酸化、冷水浴冷却、结晶、抽滤、洗涤、重结晶,得肉桂酸无色晶体。 回答下列问题:
(1)合成过程中要求无水操作,理由是______。将含结晶水的醋酸钠加热制无水醋酸钠,观察到盐由固体→液体→固体→液体。第一次变成液体的原因是_____。
(2)合成过程的加热回流,要控制皮应呈微沸状态,如果剧烈沸腾,可能导致()
A. 使肉桂酸蒸出影响产率
B. 使乙酸酐蒸出影响产率
C. 肉桂酸脱羧成苯乙烯,进而生成苯乙烯低聚物,甚至生成树脂状物
D. 反应变缓慢
(3)仪器A的名称_____:玻璃管B的作用_____。
(4)分离和提纯操作中,步骤①加Na2CO3目的是_____。
(5)水蒸气蒸馏就是将水蒸气通入不溶或难溶于水但有一定挥发性的有机物中,使该有机物在 ,低于1000C的温度下,与水共沸而随着水蒸气一起蒸馏出来。步骤②的目的____,蒸馏结束后先____,再____,以防倒吸。
(6)步骤③加活性炭目的是____:若趁热过滤在抽滤装置中进行,下列操作错误的是()
A.布氏漏斗和滤纸要事先用沸水预热
B.各步操作的动作一定要快
C.为防止滤纸破损,混和液必须用玻璃棒引流至布氏漏斗
D.吸滤瓶内的溶液可直接从支管口倒出
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省长春市高三第二次模拟考试(理综)化学部分 题型:填空题
(15分)
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下:
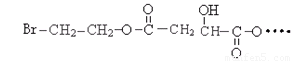
已知加热X与足理的NaOH水溶液反应时,得到A、B、C三种有机物,其中C中含
碳原子最多。室温下A经盐酸酸化可得到苹果酸E,E的结构简式为:
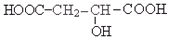
请回答:
(1) B中含有的官能团为 。(填名称)
(2)1molX与足量的NaOH水溶液充分反应,消耗NaOH的物质的量为 。
(3)C经酸化可得到有机物G,G不能发生的反应类型有 (填序号)。
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(4)1 molC酸化后与足量浓溴水充分反应需 mol Br2 。
(5) E在浓H2SO4作用下可生成六元环状化合物,其化学方程式为 。
(6)E的两种同分异构体F、G有如下特点:1molF或G可以和3molNa发生反应,放出标准状况下33.6LH2,1molF或G可以和足量NaHCO3溶液反应,生成1molCO2,1molF或G还可以发生银镜反应,生成2molAg。则F和G的结构简式分别是 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com