
| A. | 它们的原子核外电子层数随质子数的增加而增多 | |
| B. | 它们的L层电子数都相同 | |
| C. | 它们的原子核对最外层电子的引力逐渐减弱 | |
| D. | 它们与氧气或水反应时越来越剧烈 |
分析 A.元素在周期表中周期数等于其原子核外电子层数;
B.Li元素L层有1个电子;
C.原子电子层数越多,其原子核对最外层电子吸引力越小;
D.元素的非金属性越强,其单质的还原性越强.
解答 解:A.元素在周期表中周期数等于其原子核外电子层数,在周期表中,碱金属元素从上而下其周期数逐渐增大,所以其核外电子层数随着质子数增大而增多,故A正确;
B.Li元素L层有1个电子,Na、K、Rb元素的L层都含有8个电子,故B错误;
C.随着原子电子层数增多,其原子半径增大,所以原子核对最外层电子吸引力越小,故C正确;
D.元素的非金属性越强,其单质的还原性越强,所以它们与氧气或水反应时越来越剧烈,故D正确;
故选B.
点评 本题考查同一主族元素性质递变规律,为高频考点,明确元素周期律中同一周期、同一主族元素性质相似性及递变性是解本题关键,注意规律中的异常现象,注意总结归纳,题目难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 充入N2,容器内压强增大,增加了单位体积内活化分子数,反应速率加快 | |
| B. | 反应进行的净速率是正、逆反应速率之差 | |
| C. | O2的消耗速率与SO3的生成速率之比为2:1 | |
| D. | 加入SO2,可使单位体积内活化分子百分比增多,加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
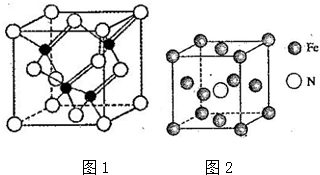
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 | |
| B. | 实验室制用乙醇与浓硫酸制乙烯时,迅速升温到140℃ | |
| C. | 盛放过苯酚的试剂瓶中残留的苯酚,用水洗涤 | |
| D. | 取加热至亮棕色的纤维素水解液少许,滴入新制的氢氧化铜悬浊液加热,证明水解产物为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
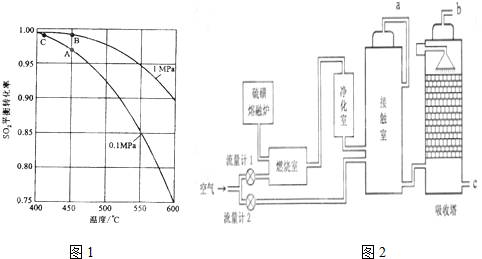
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲同学说:该条件下NaHCO3的溶解度较小 | |
| B. | 乙同学说:NaHCO3不是纯碱 | |
| C. | 丙同学説:析出NaHCO3固体后的溶液中只含氯化铵和氯化钠 | |
| D. | 丁同学说:从该反应可以获得氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1min内用O2表示的反应速率为0.03 mol•L-1•min-1 | |
| B. | 该反应的平衡常数数值为7.5 | |
| C. | SO2的平衡转化率为60% | |
| D. | 降低温度,SO2平衡浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
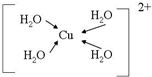 (配位键用→标出).
(配位键用→标出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com