
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和生成物共六种, 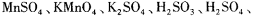
 ,其中H 2 SO 3 的还原性最强,KMnO 4 的氧化性最强。对此反应体系:
,其中H 2 SO 3 的还原性最强,KMnO 4 的氧化性最强。对此反应体系:
(1) 被氧化的元素是_______;发生还原反应的过程是________→______。
(2) 请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3) 反应中H 2 SO 4 是_______ (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4) 当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5) 用标准KMnO 4 溶液滴定H 2 SO 3 时,滴定终点时颜色变化是_______。
(6) 滴定过程中.下列图像所表示的关系正确的是_______(填编号)。 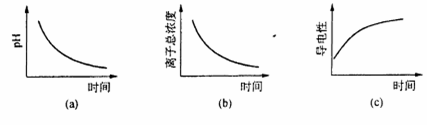
【答案】(11分) (1) +4价的 S(1分);  KMnO 4 → MnSO 4 (2分);
KMnO 4 → MnSO 4 (2分);
(2) 2MnO 4 - +5H 2 SO 3 =2Mn 2+ +5SO 4 2- +4H + +3H 2 O(1分);
(3) B、C (2分); (4) 0.01N A (或6.02×10 21 )(2分);
(5)溶液由无色变为紫红色,且半分钟内不变色 (1分);(6) (a)(c) (2分)
【解析】
试题分析:(1) H 2 SO 3 的还原性最强,说明其中的+4价的S元素易被氧化,KMnO 4 的氧化性最强,说明发生还原反应,故被氧化的元素是+4价的S,发生还原反应的过程是KMnO 4 → MnSO 4 。
3 的还原性最强,说明其中的+4价的S元素易被氧化,KMnO 4 的氧化性最强,说明发生还原反应,故被氧化的元素是+4价的S,发生还原反应的过程是KMnO 4 → MnSO 4 。
(2) H 2 SO 3 的还原性最强,反应中做为还原剂,KMnO 4 的氧化性最强,反应中做为氧化剂,离子方程式为2MnO 4 - +5H 2 SO 3 =2Mn 2+ +5SO 4 2- +4H + +3H 2 O。
(3) H 2 SO 4 是H 2 SO 3 被氧化后生成的产物,故反应中H 2 SO 4 是氧化产物,故错BC。
(4)根据离子方程式分析,2molMnO 4 - 转移电子数为10 N A 电子,故20mL 0.1mol/L,即0.002mol
的氧化剂参加反应时,电子转移数目是0.01N A (或6.02×10 21 )。
(5)反应过程中,紫红色的KMnO 4 生成为无色的MnSO 4 ,故用标准KMnO 4 溶液滴定H 2 SO 3 时,滴定终点时颜色变化是溶液由无色变为紫红色,且半分钟内不变色。
(6) 滴定过程中,有酸生成,故pH减小,故(a)正确;反应物H 2 SO 3 是弱电解质,部分电离,生成的H 2 SO 4 是强电解质,全部电离,离子难度增大,导电性增强,故(b)错误,(c)正确。故选(a)(c)。
考点:氧化还原反应的应用 酸碱中和滴定
点评:本题考查氧化反应的应用和酸碱中和滴定,题目难度中等,注意把握滴定原理以及实验的误差分析,为该题的易错点 。
。


科目:高中化学 来源: 题型:
下列说法正确的是( )
A. 浓硫酸的腐蚀性不是化学变化
B. 可以通过化学反应完成16O到18O的转变
C. 胶体的聚沉属于物理变化
D. 焰色反应一定发生化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原子结构、元素性质的说法正确的是( )
|
| A. | 非金属元素组成的化合物中只含共价键 |
|
| B. | ⅠA族金属元素是同周期中金属性最强的元素 |
|
| C. | 同种元素的原子均有相同的质子数和中子数 |
|
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有 (填编号)。
①单质 ②氧化物 ③化合物 ④盐
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
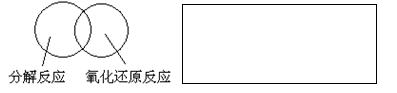 (3)有一瓶澄清的溶液,其中可能含有H + 、NH + 4 、Mg 2+ 、Ba 2+ 、Al 3+ 、I - 、NO - 3 、CO 2- 3 、SO 2- 4 、AlO - 2 ,取该溶液进行以下实验:
(3)有一瓶澄清的溶液,其中可能含有H + 、NH + 4 、Mg 2+ 、Ba 2+ 、Al 3+ 、I - 、NO - 3 、CO 2- 3 、SO 2- 4 、AlO - 2 ,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性。排除_________离子存在。
②取出部分溶液,加入少量CCl 4 及数滴新制氯水,经振荡后CCl 4 呈紫红色,可以排除 存在。
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉 淀产生,则可排除_________的存在。
淀产生,则可排除_________的存在。
④取部分上述碱性溶液加Na 2 CO 3  溶液,有白色沉淀生成,证明______存在,又排除________存在。
溶液,有白色沉淀生成,证明______存在,又排除________存在。
⑤根据上述实验事实还不能确定是否存在的离子是____ ____;
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向一定体积0.1mol/LNaOH溶液中逐滴加入等浓度的CH3COOH溶液,溶液中pOH [pOH=-lgc(OH-)]与pH的变化关系如图所示,则下列说法错误的是
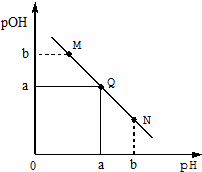
A.Q点消耗CH3COOH溶液的体积等于NaOH溶液的体积
B.M、Q、N三点都满足:c(Na+)+ c (H+)= c(CH3COO-)+c(OH-)
C.M点和N点所示溶液中水的电离程度相同
D.N点所示溶液中c(CH3COO-) <c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学活动小组欲制备一定量的氢气,下列方法不能达到目的是( )
A. Cu和稀硝酸反应 B. Zn和稀盐酸反应
C. Fe和稀硫酸反应 D. A1和稀盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
奶粉行业的“911事件”将三聚氰胺引入公众视野,工业上可用尿素为原料,在一定条件下合成三聚氰胺:6CO(NH2)2→6NH3+3CO2+C3H6N6,对C3H6N6说法正确的是( )
|
| A. | 摩尔质量为126 |
|
| B. | 相对分子质量为126g•mol﹣1 |
|
| C. | 每个C3H6N6分子含3个N2分子 |
|
| D. | 0.1 mol C3H6N6含碳原子数为1.806×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com