
【题目】氯化钠与氯化镁的混合物中,氯离子的物质的量之比为1:2,求混合物中两种物质的质量之比。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中可能大量共存的离子组是( )
A.加入金属镁能产生H2的溶液中:Na+、Fe2+、SO ![]() 、NO
、NO ![]()
B.含有大量Fe2+的溶液中:K+、Mg2+、ClO﹣、SO ![]()
C.能使Al3+生成沉淀的溶液中:NH4+、Na+、SiO ![]() 、HCO3﹣
、HCO3﹣
D.水电离产生的c(OH﹣)=1×10﹣10mol/L的溶液中:Al3+、SO ![]() 、NO
、NO ![]() 、Cl﹣
、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( ) 已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A,B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如下装置制备氢化钙. 
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为(填仪器接口的字母编号);
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;(请按正确的顺序填入下列步骤的标号);
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此推断,上述实验确有CaH2生成. ①写出CaH2与水反应的化学方程式;
②该同学的判断不正确,原因是(用相关化学方程式表示) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子组不能大量共存的是( )
A. H+、Cl— 、Na+、I— B. Cu2 +、NO3—、 K+、Br—
C. Mg 2+、Na+、HCO3—、Cl— D. Ag+、NO3—、 Na+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在世界上第一次为一种名为“钻酞箐”的分子(直径为1.3×10-9m)恢复了磁性。
“钻酞箐”的分子结构和性质.与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是( )
A. “钻酞箐”分子所形成的分散系具有丁达尔效应
B. “钻酞箐” 分子既能透过滤纸,也能透过半透膜
C. 此项工作可以用来改变分子的某些物理性质
D. 此工作可以广泛应用于光电器件、生物技术等方面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)十2H2O![]() 2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是____________________,负极的反应式是_________________。
2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是____________________,负极的反应式是_________________。
(2)一种熔融碳酸盐燃料电池原理示意如图: 电池工作时,外电路上电流的方向应从电极___(“填A或B”)流向用电器。内电路中,CO32-向电极_____(“填A或B”)移动,电极A上CO参与的电极反应为______________________。
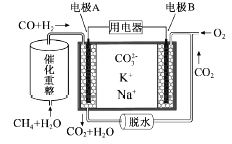
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的电极是原电池的____极,该极的电极反应式是____________________,电池工作时的总反应的离子方程式是__________________。如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为___________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铁粉与一定量的盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的( )
A.水
B.NaOH固体
C.Na2CO3固体
D.NaNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com